|
|
|
高考化学试题《弱电解质电离平衡》答题技巧(2020年最新版)(八)
2021-02-18 05:36:21
【 大 中 小】
|
1、填空题 (10分)有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
阳离子
| Na+、Ba2+、NH4+
| 阴离子
| CO32-、Cl-、OH-、SO42-
|
已知:
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。
请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 mL pH =12的C溶液加水稀释至100mL,所得溶液中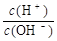 =?。 =?。
(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是?。
参考答案:(10分)(1)Na2CO3? NH4Cl? Ba(OH)2? Na2SO4(每空1分)
(2)10-6(2分)? (3)3 : 2(2分)
(4)c(OH-)>c(Cl-)=c(Ba2+)>c(NH4+)>c(H+)(2分)
本题解析:①A、C溶液的pH均大于7,可能有OH-和CO?,CO水解呈碱性。又因为A中水电离程度比纯水大,故发生水解,焰色呈黄色,有Na+存在,A为Na2CO3,②另一能水解的离子为NH?在B中, B、C相遇有刺激性气味气体,为氨气,故C中有氢氧根;③C和D相遇产生白色沉淀,在上述离子中只有BaCO3和BaSO4,阴离子互不重复,故为D为Na2SO4,C为Ba(OH)2,B为NH4Cl。
本题难度:一般
2、选择题 相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
A.仍相同
B.醋酸溶液的大
C.盐酸的大
D.无法判断
|
参考答案:B
本题解析:盐酸是强酸,醋酸是弱酸,当pH相同时,醋酸浓度大,稀释过程中,电离平衡右移,H+浓度减小程度小,稀释后pH仍相同,醋酸加水多,选B。
考点:考查弱电解质的电离。
本题难度:一般
3、简答题 为了证明一水合氨是弱电解质,甲、乙、丙三同学分别选用下列试剂进行实验探究.
可能用到的试剂是:0.10mol?L-1氨水,0.1mol?L-1NH4Cl溶液,NH4Cl晶体,酚酞试剂,pH试纸,蒸馏水等.回答以下问题:
(1)甲用pH试纸测出0.10mol?L-1氨水pH为10,则认定一水合氨是弱电解质,你认为这一方法______(填是、否)正确,说明你的理由是______.
(2)乙取出10mL?0.10mol?L-1?氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b值应满足的关系是______(用等式或不等式表示).
(3)丙取出10mL?0.10mol?L-1?氨水,滴入?2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是______,你认为这一方法______(填能、否)证明一水合氨是弱电解质.
参考答案:(1)如果氨水是强碱,0.10mol?L-1氨水C(H+)=10-140.1mol/L,pH为13,实际上溶液的pH=10<13,所以氨水是弱碱;
故答案为:是,若为强碱,则pH=13;
(2)若是强碱,稀释100倍,pH减小2个单位,由于是弱碱,稀释的过程中,会部分电离,即C(OH-)变化的幅度变小,pH减小幅度小于2个单位,则有a-2<b,且b<a;
故答案为:a-2<b<a;
(3)向氨水中加入氯化铵后,如果氨水是弱电解质,则抑制氨水的电离,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅,则说明氨水存在电离平衡;
故答案为:溶液颜色变浅,能.
本题解析:
本题难度:一般
4、选择题 下列属于强电解质的是
A.CH3CH2OH
B.NH3·H2O
C.Cu
D.NH4Cl
|
参考答案:D
本题解析:略
本题难度:一般
5、选择题 双氧水(H2O2)和水都是极弱的电解质,但H2O2比H2O更显酸性。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式: ,
(3)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式:
参考答案:(1)H2O2 H++HO2- HO2-
H++HO2- HO2-  2H++O22-
2H++O22-
(2)H2O2+Ba(OH)2=BaO2+2H2O
(3)H2O2+H2O2 H3O2++HO2-
H3O2++HO2-
本题解析:(1)过氧化氢是弱电解质,H2O2溶液显酸性属于二元弱酸分部电离,电离的方程式为: H2O2?H++HO2- HO2-?H++O22-;(2)H2O2显弱酸性,若与Ba(OH)2反应,即可看做为酸碱中和反应。其反应方程式为:H2O2+Ba(OH)2=BaO2+2H2O(3)由水电离生反应方程式:H2O+H2O H3O+OH-可知,水电离出氢离子,形成水合氢离子。故H2O2电离方程式为:H2O2+H2O2
H3O+OH-可知,水电离出氢离子,形成水合氢离子。故H2O2电离方程式为:H2O2+H2O2 H3O2++HO2-
H3O2++HO2-
考点:电离方程式的书写;离子方程式的书写
本题难度:一般
 H++HO2- HO2-
H++HO2- HO2-  2H++O22-
2H++O22- H3O2++HO2-
H3O2++HO2- H3O+OH-可知,水电离出氢离子,形成水合氢离子。故H2O2电离方程式为:H2O2+H2O2
H3O+OH-可知,水电离出氢离子,形成水合氢离子。故H2O2电离方程式为:H2O2+H2O2 H3O2++HO2-
H3O2++HO2-