1、选择题 在某密闭容器中,可逆反应:A(g)+B(g) xC(g)符合图像(Ⅰ)所示关系。由此推断,对图像(Ⅱ)的不正确的说法是( )
xC(g)符合图像(Ⅰ)所示关系。由此推断,对图像(Ⅱ)的不正确的说法是( )

A.p3>p4,y轴表示A的转化率
B.p3>p4,y轴表示B的质量分数
C.p3>p4,y轴表示C的质量分数
D.p3>p4,y轴表示混合气体的平均相对分子质量
参考答案:B
本题解析:据图像(Ⅰ)知,在压强不变时,曲线b的斜率比c的大,故T1>T2。降温(T1→T2)时,C%增大,即平衡正向移动,说明正反应为放热反应。当温度不变时,曲线b的斜率比a的大,故压强p2>p1,增大压强(p1→p2)时,C%增大,即平衡正向移动,故x<2即x=1。由图像(Ⅱ)知,保持体系温度不变,增大压强(p4→p3),平衡正向移动,C%、A、B的转化率、混合气体的平均相对分子质量均增大,而A、B的质量分数要减小,故答案为B。
本题难度:一般
2、填空题 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了下图1所示的装置。
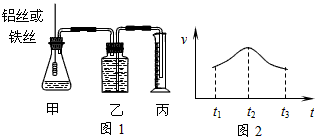
(1)检查图1装置气密性的方法是______________________________________。
(2)若要比较产生气体的快慢,可以测量相同时间内产生气体的体积,也可以测量___________________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如上图2所示,则t1~t2时间内反应速率逐渐加快的主要原因是_______________________________________。
参考答案:(1)用手捂住锥形瓶,观察乙中长导管内液面是否上升
(2)产生相同体积的气体所需时间
(3)反应放热,溶液温度升高使反应速率加快
本题解析:
本题难度:一般
3、填空题 在一容积固定的反应容器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下: A、 B和C均为4.0mol, D为 6.5mol, F为2.0mol,设E为xmol,x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中间位置。
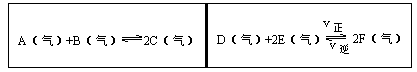
①若x=4.5,则右侧反应在起始时向______方向进行,欲使起始反应维持向该方向进行,则x的取值范围为____ 。
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?______,其理由是______。
参考答案:①当x=4.5时,正反应方向,x取值范围为3.5<x<7.0。②不同,理由见解析
本题解析:左侧可逆反应是反应前后气体的物质的量不变的反应,右侧可逆反应的正反应是气体的物质的量缩小的反应。隔板在中间意味着左右两侧可逆反应在一定条件下达到平衡时,气体的物质的量相等。左侧气体的起始量已知,共12mol,
①当x=4.5时,气体总物质的量为13.0mol,欲使右侧反应的总物质的量为12mol,应在起始时向气体体积缩小的方向进行。欲使反应向正反应方向进行,可以通过极端假设的方法来讨论:假设平衡不移动,x="12.0" mol-6.5 mol-2.0 mol=3.5mol;假设平衡向正反应方向移动使E为0 mol,(6.5-0.5x)+(2.0+x)="12.0" mol,x="7.0" mol,故x取值范围为3.5<x<7.0。②当x的取值不同时,反应分别达到平衡的气体总物质的量均为12mol,两个反应的温度肯定不同,所以左侧中的气体A的物质的量也肯定不同。
本题难度:一般
4、选择题 四个体积相同的密闭容器中,在一定条件下发生反应:反应开始时,反应速率最大的是?
容器
| 温度
| N2(mol)
| H2(mol)
| 催化剂
|
A
| 500
| 2
| 6
| 有
|
B
| 500
| 1.5
| 4.5
| 无
|
C
| 450
| 1.5
| 4.5
| 无
|
D
| 450
| 2
| 6
| 无
参考答案:A
本题解析:反应物的浓度越高,温度越高,反应速率越大,催化剂能加快反应速率,所以根据表中数据可知,反应速率最快的是现象A,答案选A。
点评:影响反应速率的外界条件一般是温度、浓度、压强、催化剂、表面积等。
本题难度:一般
5、选择题 一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示。下列判断错误的是

A.该实验方案的缺陷之一是未做空白对照实验
B.Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mmol·L-l
C.Fe3+不能提高乙酸降解速率
D.相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小
参考答案:A
本题解析:A、由于实验目的是研究Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响,所以该实验不必要做空白对照实验,A不正确;B、根据图像可知,Cu2+、Mn2+浓度等于0.1mol/L时乙酸的讲解速率最快,因此Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mmol·L-l ,B正确;C、根据图像可知,随着铁离子的加入,乙酸降解速率反而降低,这说明Fe3+不能提高乙酸降解速率,C正确;D、根据图像可知,铜离子对乙酸的降解速率提高最大,铁离子会降低乙酸的降解速率,因此相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小,D正确,答案选A。
本题难度:一般
|