1、计算题 取含MnO2的软锰矿石27.86g,跟足量浓盐酸反应,制得5.6L氯气(该状态下Cl2密度为3.17g/L)计算:
(1)这种软锰矿石中MnO2的质量分数?
(2)被氧化的HCl为多少g?
参考答案:(1)78.1%? (2)18.25
本题解析:解:(1)设该27.86g含有的MnO2的质量为x,被氧化的HCl的质量为y,根据
MnO2?+? 4HCl(浓)? =? MnCl2?+? Cl2↑
87? 146? 71
x? y? 3.17×5.6=17.752g?
即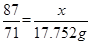 ?,解得
?,解得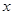 =21.752,
=21.752,
所以这种软锰矿石中MnO2的质量分数=21.752/27.86×100%="78.1%" ;
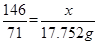 ?解得y=36.50g,即参加反应的HCl为36.50g,
?解得y=36.50g,即参加反应的HCl为36.50g,
即被氧化的HCl=1/2×36.50=18.25g。
点评:本题考查了化学反应方程式的简单计算,该题难度适中,但是要注意5.6L的氯气并不是在标准状况下的。
本题难度:一般
2、填空题 (6分)利用氧化还原反应原理配平以下化学方程式,并:
FeSO4 + KNO3 + H2SO4 === K2SO4 + Fe2(SO4)3 + NO↑+ H2O
(1)标出电子转移的方向和数目
(2)当电子转移了0.3mol时,有?g氧化剂参加反应
参考答案:

本题解析:略
本题难度:简单
3、实验题 近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
【实验目的】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:
(?)SO2 +(?)MnO4— +(?)?=(?)??+(?)Mn2+ +(?)?
根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
【实验探究】甲同学:甲同学进行了如下图所示A、B两步实验:
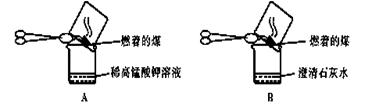
“实验现象”: A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲的方案不合理,其理由是:?
【实验探究】丙同学:丙同学进行了如下图所示实验(部分装置在图中略去):
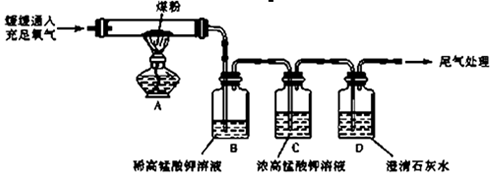
(3)上图C装置的作用是?
(4)证明煤中含有碳元素和硫元素的现象是: ?
(5)装置C中的高锰酸钾溶液也可以替换为?
A.足量I2的淀粉溶液? B.足量饱和NaHCO3溶液? C.足量Na2SO3溶液? D.足量溴水
参考答案:(1)( 5 )SO2 +( 2 )MnO4— +( 2 )H2O=( 5 )SO42-+( 2 )Mn2+ +( 4 )H+
(2)SO2也能使澄清石灰水变浑浊,不能证明煤中含有碳元素
(3)除去SO2并检验其是否除尽
(4)B中褪色, C中不褪色, D中变浑浊
(5)A D
本题解析:(1)在氧化还原反应中应该遵循质量守恒定律和电子守恒。由于该反应同时还是离子反应,因此还应该符合电荷守恒。该反应方程式为5SO2 +2MnO4— +2 H2O=5+ SO42-+2Mn2+ + 4H+。(2)A中稀高锰酸钾溶液褪色证明含有SO2;B中澄清石灰水变浑浊,则可能是SO2使澄清石灰水变浑浊的,也可能是SO2与CO2共同作用的结果。因此不能证明煤中含有碳元素。(3)在装置A中使煤充分燃烧,通过B稀酸性高锰酸钾溶液来检验SO2;通过C浓酸性高锰酸钾溶液来除去SO2,以确保完全除尽。然后在通过D澄清石灰水来检验CO2气体。若澄清的石灰水变浑浊,则证明含有CO2,否则就不含有CO2。(4)证明煤中含有硫元素的现象是B中褪色,证明含有碳元素的现象是C中不褪色, D中变浑浊。(5)高锰酸钾溶液有强氧化性,可以把SO2氧化为硫酸。若用其它物质来代替,只要物质有强氧化性,可以与SO2发生氧化还原反应即可。A.I2+SO2+2H2O=H2SO4+2HI。溶液的紫色褪去。正确。B.NaHCO3+SO2= NaHSO3+CO2.虽然能除去SO2,但是能产生CO2,会影响CO2的检验。错误。C.Na2SO3+SO2+2H2O=2NaHSO3,由于该溶液呈碱性,也能吸收CO2,所以会影响CO2的检验。错误。D.足量溴水,发生反应:Br2+SO2+2H2O=H2SO4+2HBr。但是与CO2不能发生反应,所以可以除去SO2来检验CO2。正确。因此选项为AD。
本题难度:一般
4、计算题 实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(1)用软锰矿制备K2MnO4的化学方程式是?。
(2)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为?。生成0.1mol还原产物时转移电子??个。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是?。
(3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2。若取用软锰矿制得的KMnO4产品0.165g,能与0.335g Na2C2O4恰好完全反应(假设杂质均不能参与反应),该产品中KMnO4的纯度为?。
参考答案:
(1)6KOH + KClO3?+ 3MnO2 →3 K2MnO4 + KCl + 3H2O;(1分×2)
(2)1:2(1分)、?0.2NA或6.02×10-22(1分)、? KMnO4 >K2MnO4 >MnO2(2分)?
(3)0.958(2分)
本题解析:
(1)反应物为KOH、KClO3、MnO2,生成物为K2MnO4(锰酸钾)和KCl、水,该反应为6KOH+KClO3+3MnO2═3K2MnO4+KCl+3H2O,
故答案为:6KOH+KClO3+3MnO2═3K2MnO4+KCl+3H2O;
(2)K2MnO4转化为KMnO4的反应中K2MnO4→2KMnO4+MnO2,Mn元素的化合价由+6价升高为+7价,Mn元素的化合价由+6价降低为+4价,则氧化剂和还原剂的物质的量之比为1:2,生成0.1mol还原产物时转移电子0.1mol×(6-4)××NA=0.2NA或6.02×10-22,由氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,可知氧化性为KMnO4>K2MnO4>MnO2,故答案为:1:2;0.2NA或6.02×10-22;KMnO4>K2MnO4>MnO2;
(3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2,设KMnO4的纯度为x,则由电子守恒可知,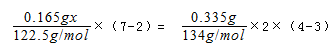
解得x=0.958,故答案为:0.958.
本题难度:一般
5、选择题 0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为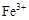 和
和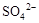 ,同
,同
时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
A.30
B.46
C.50
D.66
参考答案:BC
本题解析:根据电子守恒,0.02 mol FeS2,失电子总数:0.02*(1+14)=0.3mol,若产物全是NO,则为0.1mol,不可能。若产物全是NO2,物质的量为0.3mol这与混合气体共0.25 mol不符,不可能。若产物全是N2O4,物质的量为0.15mol这与混合气体共0.25 mol不符,不可能。所以产生气体的相对分子质量应该在(NO,NO2)和(NO2,N2O4)两种情况之间。若为(NO,NO2),设两者物质的量分别为:x,y,则有x+y="0.25,3x+y=0.3,x=0.025" y=0.225,求得M=(0.025*30+46*0.225)/0.25=44.4。若为(NO2,N2O4),设两者物质的量分别为:x,y,则有x+y="0.25,x+2y=0.3,x=0.2" y=0.05,求得M=(0.05*92+46*0.2)/0.25=55.2。即相对分子质量在44.4--55.2之间,故选BC。
本题难度:一般