1、填空题 废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:
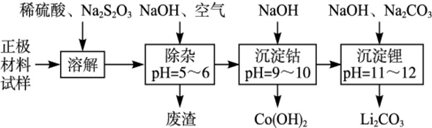
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为 ,还原产物是 。
(2)在上述除杂过程中,通入空气的作用是 废渣的主要成分是 。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为 。
(4)除了废渣可以回收利用外,本工艺还可回收的副产品是 。
参考答案:(1)8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+1lH2O CoSO4
(2)将Fe2+氧化成Fe3+;Al(OH)3 Fe(OH)3
(3)Co2++2OH-=Co(OH)2;2Li+CO32-=Li2CO3
本题解析:(1)正极材料主要含有LiCoO2及少量Al、Fe等,加入稀H2SO4、Na2S2O3,S2O32-被氧化成SO42-,具有还原性,正极材料中只有LiCoO2具有氧化性,与反应Na2S2O3反应生成CoSO4,反应化学方程式为:8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O,该反应中还原产物是 CoSO4,
(2)弱酸性条件下,铝离子和氢氧根离子反应生成氢氧化铝沉淀,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,但氢氧化亚铁不稳定易被氧气氧化生成氢氧化铁沉淀,所以废渣的成分是氢氧化铝和氢氧化铁。通入空气的作用是将亚铁离子氧化生成铁离子而除去。
(3)根据工艺流程图可知,钴离子和氢氧根离子反应生成氢氧化钴沉淀,离子方程式为:Co2++2OH-=Co(OH)2↓,碳酸根离子和锂离子反应生成碳酸锂沉淀,2Li++CO32-=Li2CO3↓
(4)稀硫酸和氢氧化钠、硫代硫酸钠反应都生成硫酸钠,且硫酸钠是可溶性的,所以溶液中存在硫酸钠,则还可以得到副产物Na2SO4。
本题难度:困难
2、选择题 对下列材料的特征及用途的说法不正确的是
A.玻璃纤维柔软如丝,可像棉纱一样纺织,但拉伸强度低
B.光导纤维传导光的能力很强,是非常好的通讯材料
C.氮化硅陶瓷耐高温且不易传热,可用于制造柴油机
D.玻璃钢强度高,密度小,耐腐蚀,可用于废水处理系统的管道
参考答案:A
本题解析:玻璃纤维不同于植物纤维,是一种高强度的新型材料。玻璃纤维虽然极细如丝,但其拉伸强度大,其拉伸强度接近于钢。显然A项错误。
本题难度:简单
3、选择题 某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1∶3,则与溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为(? )
A.21∶5
B.11∶3
C.4∶1
D.3∶1
参考答案:C
本题解析:根据电子得失守恒,假设ClO-为1mol,ClO3-为3mol,共失去电子为1+3×5=16mol;故被氧化的为1+3=4mol,被还原的为16mol,故答案选C。
本题难度:一般
4、填空题 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
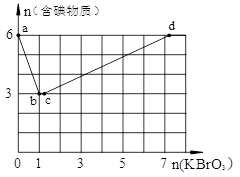
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为?。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式? ________________________________________。
(3)n(KBrO3) = 4时,对应含碘物质的化学式为?。
参考答案:(1)1 : 6;(2)BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O(3 )I2,KIO3;
本题解析:(1)b点时,KI反应完全,n(KI):n(KBrO3)=6:1,反应中KI被氧化,KBrO3被还原,反应的方程式为6I-+BrO3-+6H+=3I2+Br-+3H2O,
(2)b→c过程中,含碘物质的物质的量没有发生变化,溶液中存在Br-和BrO3-,二者发生氧化还原反应,反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O,
(3)n(KBrO3)=4时,溶液中含碘物质的物质的量介于3~6之间,部分I2被氧化生成KIO3,
本题难度:一般
5、选择题 将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如图4—1所示.符合图所示情况的是
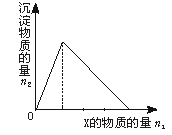
?
| A
| B
| C
| D
|
X
| NaOH
| AlCl3
| HCl
| Na[Al (OH)4]
|
Y
| AlCl3
| NaOH
| Na[Al (OH)4]
| HCl
|
?
参考答案:C
本题解析:A随着NaOH溶液的加入先后发生以下两个反应:Al3++3OH-=Al(OH)3↓(沉淀物质的量由0增至最大值);Al(OH)3+OH-=[Al (OH)4]-(沉淀物质的量由最大值降为0)。两个反应中消耗的NaOH物质的量之比为3∶1,与题图不符。
B随着AlCl3溶液的加入先后发生以下两个反应:Al3++4OH-=[Al (OH)4]-(不产生沉淀);Al3++3[Al (OH)4]-=4Al(OH)3↓(沉淀物质的量由0增至最大值)。两个反应中消耗AlCl3物质的量之比为3∶1,与题图也不符。
C随着盐酸的加入先后发生以下两个反应:H++[Al (OH)4]-=Al(OH)3↓+H2O (沉淀物质的量由0增至最大值);3H++Al(OH)3=Al3++3H2O(沉淀物质的量由最大值降为0).两个反应中消耗盐酸物质的量之比为1∶3,符合题图。
D随着Na[Al (OH)4]溶液的加入先发生以下反应:[Al (OH)4]-+4H+=Al3++4H2O(不产生沉淀);待盐酸耗尽发生Al3++3[Al (OH)4]-=4Al(OH)3↓的反应(沉淀物质的量由0增至最大值)。两个反应消耗Na[Al (OH)4]物质的量之比为1∶3,与题图也不符。
本题难度:简单