1、计算题 ?反应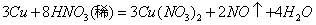 ,
,
(1)请用双线桥标出反应中电子转移的情况。(3分)
(2)若有19.2g Cu被氧化,则被还原的HNO3的质量为多少?(7分)
参考答案:(1)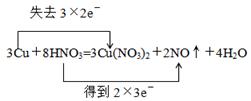 (2)12.6g
(2)12.6g
本题解析:(1)根据反应的化学方程式可知,在反应中铜的化合价从0价升高到+2价,失去个电子。硝酸中氮元素的化合价从+5价降低到+2价,得到3个电子,所以用双线桥标出反应中电子转移的情况是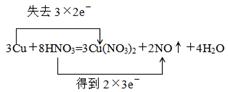 。
。
(2)19.2g铜到物质的量是19.2g÷64g/mol=0.3mol
则被还原的硝酸是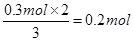
质量是0.2mol×63g/mol=12.6g
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养和解题方法的指导与训练。试题难易适中,贴近高考,有助于培养学生的逻辑思维能力和发散思维能力,提高学生的规范答题能力和应试能力。
本题难度:一般
2、填空题 (1)写出铝和氧化铁反应的化学方程式,并用双线桥法表示电子的转移情况
(2)写出下列反应的离子方程式
碳酸氢钠溶液与盐酸反应
碳酸氢钠溶液与氢氧化钠反应
氢氧化铝与盐酸反应
氢氧化铝与氢氧化钠反应
(3)写出下列反应的化学方程式Ba2+ + SO42- =BaSO4 ↓
参考答案:(1)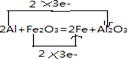
(2)HCO3-+H+= CO2 ↑+H2O HCO3-+OH-=CO32- Al(OH)3 +3H+=Al3++H2O Al(OH)3 +OH-=AlO2-+2H2O
(3)BaCl2 + Na2SO4 = BaSO4 ↓+2NaCl
本题解析:(1)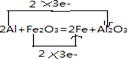
(2)碳酸氢钠溶液与盐酸反应:HCO3-+H+= CO2 ↑+H2O ;碳酸氢钠溶液与氢氧化钠反应:HCO3-+OH-=CO32- + H2O ;氢氧化铝与盐酸反应:Al(OH)3 +3H+=Al3++H2O ;氢氧化铝与氢氧化钠反应:Al(OH)3 +OH-=AlO2-+2H2O
(3)Ba2+ + SO42- =BaSO4 ↓表示可溶性的钡盐和可溶性硫酸盐的反应,化学方程式为BaCl2 + Na2SO4 = BaSO4 ↓+2NaCl
考点:考查氧化还原反应中电子转移,离子方程式的书写等知识。
本题难度:一般
3、选择题 下列叙述中,可以说明金属A的活动性比金属B的活动性强的是( ? )
A.在氧化还原反应中,A原子失去的电子比B原子失去的电子多
B.原子半径:A
C.A能与酸反应置换出H2,B不能与酸反应转换出H2
D.金属A的阳离子的氧化性强于金属B的阳离子
参考答案:C
本题解析:
本题难度:简单
4、填空题 配平下列氧化还原反应方程式:
?K2S + ?HNO3 ==?KNO3 +?NO↑+?S +?H2O
当反应中有3mol电子发生转移时,有?mol HNO3参加反应。
参考答案:(3 8 6 2 3 4) 4mol
本题解析:略
本题难度:简单
5、选择题 5NH4NO3=2HNO3+4N2↑+9H2O中,发生氧化反应与发生还原反应的氮原子个数之比 是?
是?
A.1∶3
B.5∶3
C.5∶8
D.5∶4
参考答案:B
本题解析:略
本题难度:一般