1、选择题 下列溶液中各微粒的浓度关系正确的是( )
A.25℃时,物质的量浓度相等的Na2CO3和CH3COONa溶液的pH值:Na2CO3>CH3COONa
B.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
C.1.0mol/L?Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
D.向氟化钠溶液中加入适量氢氟酸,得到的酸性混合溶液:c(F-)>c(Na+)>c(H+)>c(OH-)
2、选择题 用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是?
[?]
A.
B.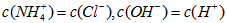
C.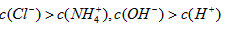
D.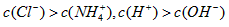
3、选择题 25℃时,在20ml0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是

[? ]
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C.在C点:c(CH3COO-)>c(Na+)>c(H+) >c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
4、选择题 常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是?
[? ]
A.弱碱的浓度大于强酸的浓度
B.反应后的溶液呈酸性
C.原氨水中有1%的含氮粒子为NH4+
D.反应后的溶液中NH4+、NH3·H2O与NH3三种粒子的平衡浓度之和为0.05?mol/L
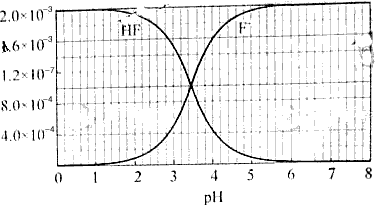
5、填空题 已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
 ?
? 
?图2
请根据以下信息回答下旬问题:
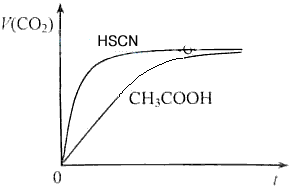
(1)25℃时,将20mL 0.10 mol/L CH3COOH溶液和20mL 0.10 mol/LHSCN溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ___________________________________________________________________________________________________________,
②反应结束后所得两溶液中,c(CH3COO-)_______c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ ,列式并说明得出该常数的理由 ________________________________________________________________________________________________________。
(3)4.0×10-3 mol/LHF溶液与4.0×10-4 mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。