1、选择题 依据离子反应:1N2H5++4Fe3+= ==4Fe2++aY+……(a是配平后Y的系数),在水溶液中N2H5+将Fe3+还原为Fe2+,则N2H5+被氧化后的产物Y可能是?(?)
A.N2
B.H2
C.NH3
D.NO
参考答案:A
本题解析:略
本题难度:一般
2、填空题 (18分)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是?。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6] 2+等。写出一种与配体CO互为等电子体的阴离子?。配体NH3中N原子的杂化类型为?, 它可用作致冷剂的原因是?。若[Ni(NH3)6] 2+为正八面体构型,则[Ni(CO)2(NH3)4] 2+的结构有?种。
(3)镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。Ni3+的电子排布式为?,NiO(OH)溶于浓盐酸的化学方程式为?。
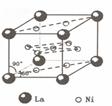
(4)镍和镧(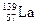 )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=??。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=??。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
LaNixHy+y NiO(OH) 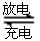 LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式?
LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式?
?
参考答案:(1)第四周期,第Ⅷ族?(2)CN— C22- sp3?液态氨汽化时需吸收大量的热? 2
(3)[Ar]3d7;或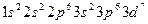 ? 2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O
? 2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O
(4)x="5?" LaNi5H6+6OH- -6e-==LaNi5+6H2O?(每空2分
本题解析:略
本题难度:简单
3、选择题 铁氧磁体法处理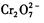 的废水的原理可概述为:向
的废水的原理可概述为:向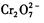 的酸性废水中加人FeSO4·7H2O ,将
的酸性废水中加人FeSO4·7H2O ,将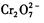 还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢXCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol
还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢXCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol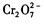 的废水至少需要加人amol FeSO4·7H2O?。下列结论正确的是?(?)
的废水至少需要加人amol FeSO4·7H2O?。下列结论正确的是?(?)
A.x= 0.5 , a=" 8"
B.x = 0.5 , a="10"
C.x = 1.5 , a=" 8"
D.x = 1.5 , a= 10
参考答案:D
本题解析:略
本题难度:一般
4、实验题 半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
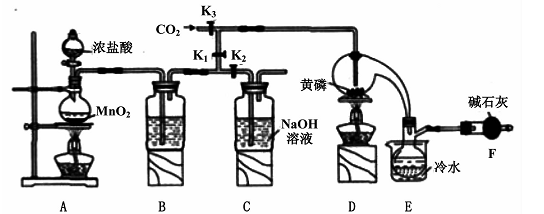
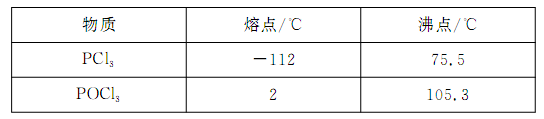
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为 ?。
(2)B中所装试剂是?,E中冷水的作用是 ?,F中碱石灰的作用是?。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是?。
(4)粗产品中常含有POC13、PCl5等。加入黄磷加热除去PCl5后.通过?(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
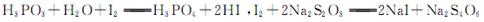 已知:?,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为?。
已知:?,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为?。
参考答案:(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)浓H2SO4;冷凝PCl3防止其挥发;吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3反应
(3)排尽装置中的空气,防止白磷自燃;
(4)蒸馏
(5)79.75%
本题解析:(1)二氧化锰和浓盐酸加热制取氯气;(2)干燥氯气用浓硫酸;根据表中PCl3的沸点可得,用冷水可以将其冷凝;根据信息可得PCl3不能遇见水蒸气,还要考虑进行尾气处理,故碱石灰的作用为吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3反应;(3)根据题目信息可知需要排尽装置内的空气;(4)根据题目信息可知利用沸点的不同将混合物分离,故蒸馏;(5)根据碘单质和Na2S2O3的反应求出剩余的碘单质,根据总的碘单质减去剩余的碘单质求出与H3PO3的物质的量,根据磷原子守恒得PCl3的物质的量,从而求出其质量分数。
本题难度:困难
5、填空题 (4分)亚硝酸钠(NaNO2)又称工业盐,其外观类似食盐,但有剧毒。近年来,建筑工地多次发生民工误食工业盐而中毒的事件。利用如下反应可鉴别NaNO2和NaCl。
___KMnO4+___NaNO2+___H2SO4=___MnSO4+___K2SO4+___NaNO3+___H2O
(1)配平上述反应的化学方程式;
(2)指出该反应的氧化剂 ;
(3)当有2mol氧化剂被还原时,则转移的电子是 mol。
参考答案:
(1)配平反应的化学方程式;
2 KMnO4+ 5 NaNO2+ 3 H2SO4=" 2" MnSO4+1 K2SO4+ 5 NaNO3+ 3 H2O 2'
(2)指出该反应的氧化剂 KMnO4; 1'
(3)当有2mol氧化剂被还原时,则转移的电子是 10 mol。 1'
本题解析:在本题中考察学生对于氧化还原反应中对于氧化剂和还原剂的判定以及反应方程式的配平,KMnO4是常用的强氧化剂,NaNO2则作为还原剂;根据配平的情况知道,Mn由+7价降到了+2价,每mol转移的电子为5mol,由于反应中2mol氧化剂被还原,因此转移的电子为10mol。
考点:氧化还原反应的配平和计算。
点评:本题属于常规考题,对氧化还原反应的配平,应当利用电子得失守恒以及元素守恒,转移的电子数要根据价态进行判断。
本题难度:困难