1、填空题 (4分)配平氧化还原反应方程式。
(1) ?NH3+ ?NO2— ?N2+ ?H2O
(2) 氧化产物与还原产物的质量比为 ?。
参考答案:(4分)(1)8 6 14 12?(2)4:3
本题解析:本题考查氧化还原反应方程式的配平
(1)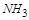 中
中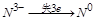 ,
,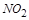 中
中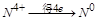 ,得失电子数的最小公倍数为
,得失电子数的最小公倍数为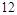 ,
,
在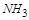 前配系数
前配系数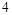 ,在
,在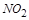 前配系数3,则
前配系数3,则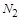 前配系数为
前配系数为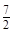 ,再配平
,再配平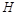 ,在
,在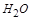 前配
前配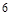 ;
;
即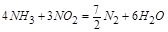
此方程式的两端同乘以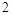 得
得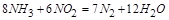
(2) 在反应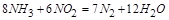 中,
中,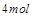
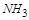 被氧化成
被氧化成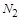 ,
,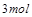
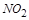 被还原
被还原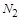 ,产物均为
,产物均为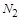 ,因而氧化产物与还原产物的质量比为
,因而氧化产物与还原产物的质量比为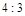 .
.
本题难度:简单
2、选择题 金属中导电性能最强的是
A.铜
B.银
C.铝
D.铁
参考答案:B
本题解析:金属的导电性由强到弱依次为银、铜、铝、铁。
本题难度:简单
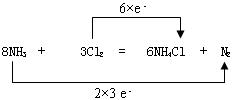
3、填空题 (10分)根据反应8NH3+3Cl2=6NH4Cl+N2回答下列问题。
(1)氧化剂?,还原剂?
(2)用双线桥法标出反应中电子转移情况?
(3)氧化剂与氧化产物的质量比__________
(4)当生成28gN2时,被氧化的物质的质量是__________g。?
参考答案:(10分)(1)Cl2,NH3
(2)
(3)___213_∶_28_____?(4)___34____g。
本题解析:略
本题难度:一般
4、填空题 (4分)完成并配平下列化学方程式□FeO + □HNO3 → □Fe(NO3)3 + NO↑+ □ ,当生成2mol NO时,转移的电子数为 NA。
参考答案:3 10 3 5H2O 6
本题解析:缺项物质是水。Fe由+2价升为+3价,升高1,N由+5价降为+2价,降低3,所以氧化亚铁和硝酸铁前面配3,一氧化氮前面配1,由氮原子守恒硝酸前面配10,水前面配5。由方程式知当生成1molNO时转移电子3mol。
考点:氧化还原反应配平 化学计算
点评:缺项配平中,所缺物质一般是酸、碱和水,若为离子方程式,所缺物质一般是H+、OH-或H2O。
本题难度:一般
5、填空题 Ⅰ.某溶液中仅含下表离予中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均相等都为0.0lmol。
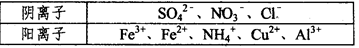
①若向原溶液中加入KSCN溶液,无明显变化。
②若向原溶液中加入过量的盐酸,有气体生成.溶液中阴离子种类不变。
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题
(1)若先向原溶液中先加入过量的盐酸,再加入KSCN溶液,现象是__________________。该过程中涉及的离子方程式有________________、__________________。
(2)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体为____________________(写化学式)。
(3)向原溶液中加入足量盐酸后,用排水法收集所产生的气体并使气体恰好充满容器,将容器倒置于水槽中,再向容器中通入___________mLO2(气体体积均指标准状况),能使溶液充满该容器。
Ⅱ.amolCu2S和bmol FeS投入到v L c mol/L的稀硝酸中;充分反应,生成NO气体,所得澄清溶液可以看作Cu(NO3)2、Fe(NO3)3和H2SO4的混合溶液,则反应中未被还原的硝酸的物质的量为? ___________mol(用同时含有a、b、v、c的表达式表示)。
Ⅲ.已知CH4(g)+2O2(g) CO2(g)+2H2O(l)?△H1=a kJ/mol欲计算反应CH4(g)+4NO(g)
CO2(g)+2H2O(l)?△H1=a kJ/mol欲计算反应CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
据此计算出△H2=_____________kJ/mol(用含a和b的式子表示)。
参考答案:I.(1)有气泡产生,溶液变成(血)红色(2分)(只要给出溶液变成(血)红色即得分)
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O、Fe3++3SCN-= Fe(SCN)3(写成可逆符号给分)(2分)
(2)Fe2O3、CuO(2分)(漏写一种得一分,有错写不给分)(其他合理答案也可)
(3)56(2分)
Ⅱ.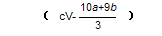 ?(2分)
?(2分)
Ⅲ.?N2(g) + O2(g)=2NO(g)?△H3 =" b" kJ/mol (2分)? a - 2b(2分)
或2NO(g)=N2(g) + O2(g)?△H3 =" b" kJ/mol?a +2b
本题解析:依题意可以推出溶液中含有的离子种类应有Fe2+,NO3-,Cu2+?,SO42-,Cl-。可以回答问题(1)。(2)应考虑Fe(OH)2在加热时生成Fe(OH)3,Cu(OH)2和Fe(OH)3在灼烧时生成Fe2O3、CuO。(3)因为4NO + 3O2 + 2H2O = 4HNO3,利用Fe2+的量为0.01mol,可以算出O2的体积。Ⅱ利用电子得失守恒可以推出被氧化的硝酸为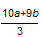 ,用硝酸的总量减去被氧化的硝酸可以求出。Ⅲ可以利用盖斯定律,欲计算反应CH4(g)+4NO(g)
,用硝酸的总量减去被氧化的硝酸可以求出。Ⅲ可以利用盖斯定律,欲计算反应CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(l),我们还需要知道N2与NO的关系。带入N2(g) + O2(g)=2NO(g)?△H3 =" b" kJ/mol,△H2=△H1-2△H3
2N2(g)+CO2(g)+2H2O(l),我们还需要知道N2与NO的关系。带入N2(g) + O2(g)=2NO(g)?△H3 =" b" kJ/mol,△H2=△H1-2△H3
本题难度:困难