|
|
|
高中化学必备知识点《物质的量》高频试题预测(2020年最新版)(八)
2021-02-18 06:21:36
【 大 中 小】
|
1、简答题 实验室要配制100mL?0.2mol?L-1?Na2CO3溶液.请回答下列问题.
(1)用托盘天平称取无水碳酸钠固体的质量为______?g.
(2)需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和______.
(3)下列操作中,可能造成所配制溶液的浓度偏低的是______(填序号).
①碳酸钠固体未充分干燥?②称量时左盘放砝码?③转移溶液时有少量滴洒.
参考答案:(1)实验室配制1mol/L的Na2CO3溶液100mL需要Na2CO3的质量为:0.1L×0.2mol/L×106g/mol=2.1g.
故答案为:2.1g.
(2)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.
所以需要的仪器有托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管.
所以还需要用的仪器为:托盘天平、药匙、100mL容量瓶.
故答案为:托盘天平、药匙、100mL容量瓶.
(3)①碳酸钠固体未充分干燥,实际称取的碳酸钠的质量偏小,所配溶液的浓度偏低;
②称量时左盘放砝码,由于使用游码,实际称量的碳酸钠的质量为1.9g,称取的碳酸钠的质量偏小,所配溶液的浓度偏低;
③转移溶液时有少量滴洒,移入容量瓶内碳酸钠的物质的量减少,所配溶液的浓度偏低.
故选:①②③.
本题解析:
本题难度:一般
2、简答题 实验室需配制250mL?0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制250mL?0.1mol/L的Na2CO3溶液
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器
______
______
______
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.用托盘天平准确称取所需Na2CO3固体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作______;若加蒸馏水时不慎超过了刻度______;若定容时俯视刻度线______.
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度______;向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面______.
参考答案:(1)需Na2CO3的质量为m=0.25L×0.1mol?L-1×106g/mol=2.65g≈2.7g.
故答案为:2.7g.
配制250mL?0.1mol/L的Na2CO3溶液,所以应选择250ml容量瓶.
操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管、药匙.
除容量瓶外还需要的仪器有天平、烧杯、玻璃棒、胶头滴管、药匙.
故答案为:2.7;250ml;天平、烧杯、玻璃棒、胶头滴管、药匙.
(2)由(1)中配制溶液的操作步骤可知,正确的操作顺序是B、C、A、F、E、D.
故答案为:B、C、A、F、E、D.
(3)若未洗涤,碳酸钠沾在烧杯壁与玻璃棒上,碳酸钠的实际质量减小,所配溶液浓度偏低;
若加蒸馏水时不慎超过了刻度,导致所配溶液的体积增大,所配溶液浓度偏低;
若定容时俯视刻度线,使溶液的体积偏小,所以溶液浓度偏高.
故答案为:偏低;偏低;偏高.
(4)加蒸馏水时不慎超过了刻度或向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面,导致所配溶液浓度偏低,应宣告实验失败,洗净容量瓶后重新配制.
故答案为:应宣告实验失败,洗净容量瓶后重新配制;应宣告实验失败,洗净容量瓶后重新配制.
本题解析:
本题难度:一般
3、选择题 实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19 g·cm-3,则该浓盐酸物质的量浓度是( )
A.11.9
B.11.9 mol·L-1
C.0.012 mol·L-1
D.无法计算
|
参考答案:B
本题解析:盐酸的溶质质量分数为36.5%,密度为1.19g/cm3,物质的量浓度为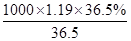 =11.9mol/L,答案选B. =11.9mol/L,答案选B.
考点:物质的量浓度的计算
本题难度:一般
4、选择题 将质量分数为a%,物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数 变为2a%,此时该H2SO4的物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是
A.c2=2c1
B.c2>2c1
C.c2<2c1
D.无法确定
|
参考答案:B
本题解析:蒸发掉原溶液质量一半的水后,则溶液中溶质的质量分数变为2a,设质量分数为a的H2SO4的密度为ρ1g/mL,蒸发后密度为ρ2g/mL,根据物质的量浓度与溶液密度、质量分数的关系有:C1=1000ρ1a/98
C2=2000ρ2 a/98,得C1
本题难度:一般
5、填空题 (8分)(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为________。
(2)向等体积、等浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为________。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗Na、Mg、Al的物质的量之比为________。
(4)足量的Al分别与等浓度的硫酸、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为________。
参考答案:(1)1:2:3 (2)6:3:2 (3)6:3:2 (4)3:2
本题解析:(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,即n(NaCl)=n(MgCl2)=n(AlCl3).由于它们分别电离产生的Cl-个数是1、2、3,所以若分别与足量的AgNO3溶液反应,生成AgCl沉淀的物质的量的比是1:2:3,m=nM.质量比等于物质的量的比,因此质量之比为1:2:3. (2)等体积、等浓度的AgNO3溶液中,含有Ag+的物质的量相同,若分别加入NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则消耗的Cl-的物质的量相同。由于n=C·V,它们的体积相等,则Cl-的浓度就相等。由于三种物质等物质的量时产生的Cl-的个数比是1:2:3,所以三种溶液的物质的量浓度之比为1:1/2:1/3=6:3:2。(3)由于金属足量。所以产生的氢气按照金属来计算。在反应中生成气体的质量相同,则金属失去的电子的物质的量相同,假设都失去电子1mol,则需要消耗Na、Mg、Al的物质的量分别是1mol、1/2mol;1/3mol,所以它们的物质的量的比是1:1/2:1/3=6:3:2。(4)足量的Al分别与等浓度的硫酸、氢氧化钠溶液反应,根据方程式2Al+3H2SO4 =Al2 (SO4)3+3H2↑; 2Al+2NaOH +2H2O= 2NaAlO2 +3H2↑可知:当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为物质的量的比,等于3:2.
考点:考查物质的量的有关计算的知识。
本题难度:一般