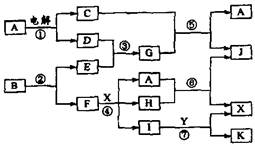
1、填空题 (12分)(2004江苏高考题)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
(1)写出下列物质的化学式:A:?,E:?
F:?,Y:?。
(2)反应⑤的化学方程式为:?。
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为:?。
参考答案:(1)H2O? N2? Ag? HCl? (2)4NH3+5O2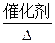 ?4NO+6H2O? (3)AgN3
?4NO+6H2O? (3)AgN3
本题解析:略
本题难度:一般
2、简答题 X、Y、Z、W四种化合物均由1~18号之间的元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去).请回答:

(1)W的化学式是______.
(2)X与Y在溶液中反应的离子方程式是______.
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用右图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体.
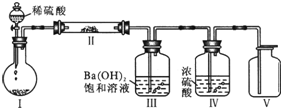
①写出装置Ⅰ中反应的化学方程式是______;装置Ⅱ中物质的化学式是______.
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下也可制备得装置Ⅴ中气体,该化合物的化学式是______,试指出装置I中圆底烧瓶中所盛装的药品是______.
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是______.
参考答案:X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,这四种化合物均为短周期元素组成,且W为无色无味的气体(中学阶段常见的无色无味的气体为H2、O2、CO2等),
可推出X为NaHCO3,Y为NaOH,Z为Na2CO3,W为CO2.
X与Y在溶液中反应是NaHCO3+NaOH=Na2CO3+H2O,离子方程式是HCO3-+OH-=CO32-+H2O.
X所含的四种元素为:Na、H、C、O,
这四种元素组成的化合物有:NaHCO3、Na2CO3、NaOH、H2CO3、Na2O、Na2O2、NaOH、H2O、H2O2、CO2、CO等无机物和烃、烃的含氧衍生物等有机物.
根据装置Ⅲ中Ba(OH)2饱和溶液产生白色沉淀,且图示中装置I、Ⅱ中的物质均为固体,
推测装置I中的物质为NaHCO3或Na2CO3固体.装置Ⅰ中反应的化学方程式:Na2CO3+H2SO4=
Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O;
因为装置Ⅴ中收集到一种无色气体,说明装置I中产生的CO2与装置Ⅱ中的物质反应生成了另一种无色气体,进而推测出装置Ⅱ中的物质为Na2O2,装置Ⅴ中收集的气体是O2.O2的制取也可以用2H2O2 ?MnO2?.?2H2O+O2↑进行.
将Cl2通入Na2CO3溶液中,制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,
说明部分产物为NaClO和NaHCO3,其余的产物可根据元素守恒得出,并配平,
反应的化学方程式为:2Na2CO3+C12+H2O=NaClO+NaCl+2NaHCO3.
故答案为:
(1)CO2
(2)HCO3-+OH-=CO32-+H2O?
(3)①Na2CO3+H2SO4=Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O;Na2O2?
②H2O2;? MnO2
(4)2Na2CO3+C12+H2O=NaC1O+NaCl+2NaHCO3
本题解析:
本题难度:一般
3、选择题 有a、b、c、d、e五种气体,进行下列实验:
| (1)a和b混合 | 气体变红棕色
(2)c和d混合
产生白烟
?(3)c和e分别通入少量溴水中
溴水都变成无色透明的液体
(4)b和e分别通入氢硫酸中
都产生淡黄色浑浊
|
a、b、c、d、e依次可能是( )
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO3
C.NO、O2、NH3、HCl、SO2
D.HCl、CO2、NH3、H2S、CH4
参考答案:C
本题解析:
本题难度:简单
4、推断题 已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如右(部分产物已略去)。
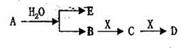
请回答下列问题:
(1) 常温常压下,3.9gA与足量的氷充分反应放出热量akJ,写出该反应的热化学方程式________
(2) 向500mL0.3mol/L的B溶液中缓慢通入2.24L(标准状况下)的气体X,则所得混合溶液中各离子浓度由大到小的顺序是________________
(3) 已知20°C时的溶解度:S(Na2CO3)=21.2g,S(NaHCO3)=9.6g。则20°C恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3________g (小数点后保留1位)
(4) 现有甲、乙两瓶无色溶液,已知它们可能是以下四种溶液:MgCl2溶液、 AlCl3溶液、NaOH溶液、氨水中的两种,现做如下实验:
①取440mL甲与120mL乙反应,产生1.56g白色沉淀M
②取440mL乙与120mL甲反应,也产生1. 56g白色沉淀M
③取120mL甲溶液与400mL乙溶液反应,则产生3.12g白色沉淀M;通过必要的计算和推理判定:甲溶液为__________溶液,乙溶液为________溶液。
参考答案:
(1)2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)? △H=-40akJ·mol-1
(2)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
(3)24.3
(4)AlCl3;NaOH
本题解析:A是淡黄色固体且可与水反应,A为Na2O2,则E为O2,B为NaOH,X为气体,且可和NaOH发生特征反应,则X为CO2,C为Na2CO3,D为NaHCO3。
(1)3.9gNa2O2的物质的量是0.05mol,写热化学方程式时Na2O2的化学计量数是2,因此反应热为-40akJ·mol-1。
(2)根据反应方程式2NaOH+CO2=Na2CO3+H2O及Na2CO3+H2O+CO2=2NaHCO3,可知0.5×0.3="0.15mol" NaOH与2.24÷22.4="0.1mol" CO2反应,反应后得到的是含有等物质的量的Na2CO3和NaHCO3的混合溶液,CO32-的水解程度大于HCO3-,溶液显碱性,则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
(3)121.2g饱和碳酸钠溶液中含有碳酸钠21.2g,根据反应Na2CO3+H2O+CO2=2NaHCO3可知,通入足量的CO2后,21.2g碳酸钠可生成NaHCO3的质量为33.6g,NaHCO3的溶解度为9.6g,因此可析出固体33.6-9.6=24g;碳酸钠转化成NaHCO3时要消耗水,21.2g碳酸钠消耗水3.6g,减少的水中溶解的NaHCO3质量为0.345g,因此共析出NaHCO3质量为24.3g。
(4)通过实验②③对比,可知沉淀可溶于过量的乙,四种溶液产生的沉淀可溶于其中一种溶液的,是Al(OH)3与NaOH,因此甲为AlCl3,乙为NaOH。
本题难度:困难
5、推断题 物质A~G是中学化学中常见的物质,这些物质有如图所示的转化关系(部分反应物、生 成物没有列出)。其中A、B、F含有一种相同的元素,C、D、G含有一种相同的元素,F具有磁性,G 为黑色非金属单质。
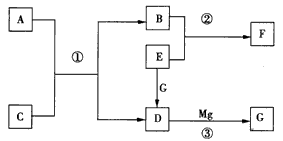
(1)物质A溶解于盐酸,然后加入KSCN溶液,溶液不变色,再滴加几滴氯水,溶液变为血红色,由此推知A的化学式为____。
(2)反应③的化学方程式是___。
(3)写出下列物质的化学式.E___、F___。
(4)若C是一种气体,在温度为1100 ℃的某固定容积的密闭容器中发生反应:A(s)+C(g) 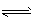 B(s)+D(g) △H=akJ/mol(a>0),该温度下平衡常数K=0.263。若生成1 mol B,则吸收的热量____(选填“大于”、“等于”或“小于”)a kJ;若加入过量的A,则C的转化率__ (选填“升高”、“不变”或“降低”);若容器内压强不再随时间变化,则该反应__ (选填“达到”、“未达到”或“不一定达到”)化学平衡状态;该反应达到化学平衡状态时,若c( C) =0. 100 mol/L,则c(D)=___mol/L。
B(s)+D(g) △H=akJ/mol(a>0),该温度下平衡常数K=0.263。若生成1 mol B,则吸收的热量____(选填“大于”、“等于”或“小于”)a kJ;若加入过量的A,则C的转化率__ (选填“升高”、“不变”或“降低”);若容器内压强不再随时间变化,则该反应__ (选填“达到”、“未达到”或“不一定达到”)化学平衡状态;该反应达到化学平衡状态时,若c( C) =0. 100 mol/L,则c(D)=___mol/L。
参考答案:(1) FeO
(2) CO2+2Mg C +2MgO
C +2MgO
(3)O2;Fe3O4
(4)等于;不变;不一定达到;0. 026 3
本题解析:
本题难度:一般