1、填空题 (15分)
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1)组成单质A的元素位于周期表中第?周期,第?族。
(2)B与氢氧化钠溶液反应的化学方程式为:
? ?。
?。
(1)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为?
?,当生成2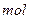 二氧化氯时,转移电子?
二氧化氯时,转移电子?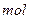 。
。
(2)溶液F在空气中长期放置生成H的化学反应方程式为:
?。
(3)H的溶液与稀硫酸反应产生的现象为?
?。
2、推断题 根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示)
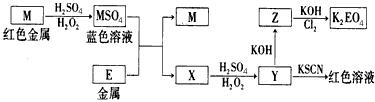
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:______________________。
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:__________________________
(3)写出Cl2将Z氧化为K2EO4的化学方程式:_______________________
(4)由E制备出的E(C5H5),的结构如下图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: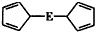 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有
_________种峰,错误的结构有__________ 种峰。
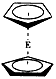
3、填空题 (14分)下图中A、B均为固体,其中B为单质。下图可用于工业生产F,F是衡量一个国家化工水平的标志。回答下列问题:
(1)A的化学式?
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,
转移电子?mol
(3)写出D与铝单质反应的化学方程式?
(4)反应②是可逆反应,在2 L的密闭容器中投入 4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是?
4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是?
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X的量来 提高C的转化率
提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出2.24L气体C与0.15mol氢氧化钠溶液反应的离子化学方程式
?
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是??写出F的一种用途?
4、简答题 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含一种金属元素.A和D最外层电子数相同;C与B、E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙).请回答下列问题:
(1)甲的结构式为______;写出乙的一种用途______;
(2)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,所产生的气体可充填气球,请写出该反应的离子方程式______.该种气球存在的隐患是______;
(3)检验A、B、C三种元素组成的某盐溶液中阳离子的方法是______.已知该盐溶液常温下呈酸性,则0.1mol?L-1该盐溶液中浓度最大的离子为______(写离子符号);
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式______;
(5)经检测,某固体粉末中仅含C和D两种元素组成的化合物,请设计实验方案探究该固体粉末的成分______.
5、选择题 已知下列转化关系中M、N均为单质.则M不可能是
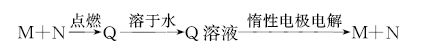
A.Na
B.Cu
C.H2
D.Cl2