1、选择题 一些烷烃的燃烧热如下表
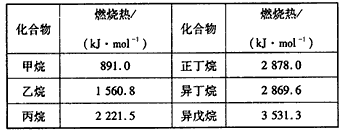
下列表达正确的是
[? ]
A.正戊烷的燃烧热小于3531.3 kJ/mol
B.稳定性:正丁烷>异丁烷
C.乙烷燃烧的热化学方程式为:2C2H6(g) +7O2(g)= 4CO2(g)+6H2O(g);△H=-1560.8 kJ/mol
D.相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多
参考答案:A
本题解析:
本题难度:一般
2、选择题 常温时,将V1mL c1mol·L-1的氨水滴加到V2mL c2moL·L-1的盐酸中,下列结论中正确的是
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则溶液中c (NH4+) =c (Cl-)
C.若混合溶液的pH=7,则溶液中c (NH4+)>c (Cl-)
D.若V1=V2,且混合液的pH<7,则可能有c1 = c2
参考答案:AD
本题解析:氨水是弱碱,若恰好反应,则生成的氯化铵水解,溶液显酸性。如果显中性,说明氨水是过量的,A、D正确,B不正确。根据电荷守恒c (H+) +c (NH4+) =?c (Cl-)+c (OH-)可知,如果混合溶液的pH=7,则溶液中c (NH4+)=c (Cl-),C不正确。答案选AD。
本题难度:一般
3、选择题 同温同PH值的CH3COOH和(NH4)2SO4溶液中,由H2O电离出的H+的物质的量浓度
A.前者小
B.前者大
C.相等
D.不能确定
参考答案:A
本题解析:略
本题难度:一般
4、填空题 某温度(t ℃)时,水的离子积为KW=1.0×10-13mol2·
L-2,则该温度(填“大于”、“小于”或“等于”)________25 ℃,其理由是
____________________________________________________________。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是____________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是__________________________________________。
参考答案:大于 水的电离是吸热过程,KW随温度升高而增大 (1)10∶1
c(Na+)>c(SO42—)>c(H+)=c(OH-)或c(Na+)=2c(SO42—)>c(H+)=c(OH-) (2)9∶2? c(H+)>c(SO42—)>c(Na+)>c(OH-)
本题解析:水的电离是吸热过程,KW随温度升高而增大,故温度高于25 ℃。
(1)稀H2SO4中,c(H+)=0.1 mol·L-1,NaOH溶液中c(OH-)=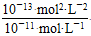 =0.01 mol·L-1
=0.01 mol·L-1
01 mol·L-1×a L=0.1 mol·L-1×b L
a∶b=10∶1
离子浓度关系c(Na+)>c(SO42—)>c(H+)=c(OH-)或c(Na+)=2c(SO42—)>c(H+)=c(OH-)
(2)若pH=2,则
c(H+)混=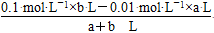 =0.01 mol·L-1
=0.01 mol·L-1
a∶b=9∶2
离子浓度关系:此时,假如原来NaOH溶液为9 L,H2SO4溶液则为2 L
n(Na+)=0.01 mol·L-1×9 L=0.09 mol
剩余n(H+)=0.01 mol·L-1×(9 L+2 L)=0.11 mol
n(SO42—)=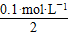 ×2 L=0.1 mol
×2 L=0.1 mol
所以:c(H+)>c(SO42—)>c(Na+)>c(OH-)。
本题难度:一般
5、计算题 (每小题2分,共6分)已知室温下KW = 1.0×10—14。
(1)计算室温条件下0.1mol/LHCl溶液中由水电离的氢离子浓度。
(2)计算室温条件下0.01mol/LNaOH溶液的PH。
(3)计算上述两种溶液完全中和至中性时,需要两溶液的体积比。
参考答案:

本题解析:略
本题难度:简单