1、选择题 下列各组热化学方程式中,化学反应的△H前者大于后者的是
[? ]
①C(s)+O2(g)==CO2(g);△H1 C(s)+1/2O2(g)==CO(g);△H2
②S(s)+O2(g)==SO2(g);△H3 S(g)+O2(g)==SO2(g);△H4
③H2(s)+1/2O2(g)==H2O(l);△H5 2H2(g)+O2(g)==2H2O(l);△H6
④CaCO3(s)==CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)==Ca(OH)2(s);△H8
A.①
B.④
C.②③④
D.①②③
参考答案:C
本题解析:
本题难度:简单
2、选择题 已知H2(g) +1/2O2(g)= H2O(l) ΔH = -285.8 kJ·mol-1。下列说法不正确的是
[? ]
A.H2的燃烧热为285.8 kJ·mol-1
B.2H2(g) + O2(g) = 2H2O(l) ΔH = -571.6 kJ·mol-1
C.1 mol H2完全燃烧生成气态水放出的热量大于285.8 kJ
D.形成1 mol H2O的化学键释放的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
参考答案:C
本题解析:
本题难度:简单
3、填空题 合成氨反应N2(g)+3H2(g) 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
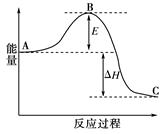
请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变_____(填“大”或“小”),E的大小对该反应的反应热有无影响?_ _。理由是_________ ;
(2)图中ΔH=________kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2,经过50 min,NH3的浓度为1mol·L-1,
则v(N2)=____________mol·L-1·min-1、C(H2)=______________mol·L-1;
已知NH3(g)= NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)=2NH3 (l)的热化学方程式 ________ 。
参考答案:(1)小,无。△H取决于反应物的总能量和生成物的总能量差;(2)-92.2 (3)0.01 4
(4)N2(g) + 3H2(g) ? 2NH3(g) ΔH=-(92.2+Q)kJ·mol-1
本题解析:(1)用铁作催化剂可以降低反应活化能E,所以加催化剂会使图中E变变小;△H取决于反应物的总能量和生成物的总能量差,所以E的大小对该反应的反应热没有影响。
(2)NH3的物质的量为17g/17g·mol-1="1mol" △H="2×-46.1" kJ="-92.2" kJ(该反应为放热反应,符号为负)
(3)NH3的变化浓度为1mol·L-1时,根据反应比,N2的浓度变化了0.5mol·L-1,v(N2)=0.5mol·L-1/50 min="0.01" mol·L-1;NH3的变化浓度为1mol·L-1时,根据反应比,H2的浓度变化了1.5 mol·L-1,C(H2)=5.5 mol·L-1-1.5 mol·L-1="4" mol·L-1
(4)N2(g) + 3H2(g) ? 2NH3(g) ΔH=-(92.2+Q)kJ·mol-1
考点:本题着重考查了化学反应热、化学反应速率计算的相关知识。
本题难度:一般
4、填空题 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为______.
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:______.
Ⅱ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),下列各项能说明反应达到平衡状态的是______.
a.体系压强保持不变?b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变?d.每消耗1molO2同时生成2molNO2
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH
浓度(mol?L-1)
0.9
1.0
0.6
|
①列式并计算平衡常数K=______.
②若降低温度,K值增大,则反应的△H______0(填“>”或“<”).
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正______v逆(填“>”、“<”或“=”).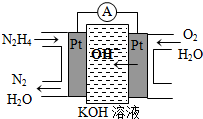
参考答案:Ⅰ.(1)左端为负极,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O,故答案为:N2H4-4e-+4OH-=N2+4H2O;
(2)由①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
根据盖斯定律可知②×2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),△H=(-534.0kJ?mol-1)×2-(-67.7kJ?mol-1)-(-52.7kJ?mol-1)=-947.6?kJ?mol-1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6?kJ?mol-1,故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6?kJ?mol-1;
Ⅱ.(1)反应2NO(g)+O2(g)?2NO2(g),为反应前后气体的物质的量不等的反应,则
a.体系压强保持不变,则该反应达到平衡,故a正确;?
b.该混合物中只有二氧化氮为红棕色气体,则混合气体颜色保持不变,即物质的浓度不变,则反应达到平衡,故b正确;
c.NO和O2的物质的量之比保持不变,则各物质的物质的量不发生变化,该反应达到平衡,故c正确;?
d.每消耗1molO2同时生成2molNO2,只能说明正反应速率的关系,不能确定正逆反应速率的关系,则不能判断是否平衡,故d错误;
故答案为:abc;
(2)①由表格中平衡浓度,则算平衡常数为K=0.60.9×(1.0)2=23L2?moL-2?(或0.67?L2?moL-2),
故答案为:23L2?moL-2?(或0.67?L2?moL-2);
②降低温度,K值增大,则降低温度时平衡正向移动,即正反应为放热反应,△H<0,故答案为:<;
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,Qc=11.5×(1.0)2L2?moL-2=K,则平衡不移动,即正逆反应速率相等,故答案为:=.
本题解析:
本题难度:一般
5、选择题 已知热化学方程式C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是
A.乙炔的燃烧热为1256kJ/mol
B.若转移10mol电子,则消耗2.5mol O2
C.若生成2mol液态水,则△H=-2512kJ/mol
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ