1、选择题 下列有关物质制备的说法中正确的是?
[? ]
A.工业上通过电解MgO制取镁?
B.工业上通过向浓缩的海水中通入氯气获得碘
C.工业上主要通过高温冶炼黄铜矿获得铜
D.工业上用二氧化锰与浓盐酸制备氯气
参考答案:C
本题解析:
本题难度:简单
2、选择题 气体打火机使用一种有机化合物为燃料,这种燃料稍加压时易液化,减压时气化,点燃能燃烧.下列符合这种条件的有机物是(括号内为各物质的沸点)( )
A.C2H6(-88.6℃)
B.C3H8(-42.6℃)
C.C4H10(-0.5℃)
D.C5H10(36.1℃)
参考答案:C
本题解析:
本题难度:一般
3、填空题 氮氧化铝(AlON)具有优异的物理、化学性质,具备多晶陶瓷在材料制备方面的优势,是优秀的光学窗口材料,有着广阔的应用前景。工业上采用氧化铝的碳热还原氮化反应制得,其有关工艺流程如下
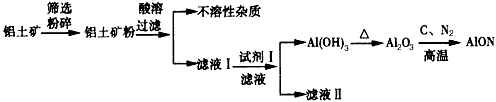
(1)铝土矿粉酸溶时酸不宜过量太多的原因是_________________。
(2)试剂I的化学式为_______,反应的离子方程式为___________________。
(3)写出制备AlON的化学方程式__________________。
(4)滤液Ⅱ的一种重要用途是____________。
参考答案:(1)酸越多,后面消耗的碱就越多
(2)NH3·H2O;Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(3)Al2O3+C+N2 2AlON+CO
2AlON+CO
(4)作化肥
本题解析:
本题难度:一般
4、填空题 具有硬度大、熔点高、耐酸腐蚀而被应用于航空、电子等领域,由钛铁矿(主要成份是FeTiO3,钛酸亚铁)提取金属钛并获得副产品FeSO4·7H2O的工艺过程如下
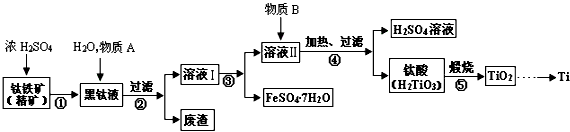
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,常温下,该物质易溶于酸性溶液,在pH=0.5时开始转化为钛酸沉淀,
①则物质A是______(填化学式,下同),B是______;
②步骤④生成TiO(OH)2(即H2TiO3)的离子方程式是________________________。
(2)已知FeSO4·7H2O的溶解度曲线如下图所示,则步骤③采用的操作是________________________

(3)工业上可通过下列反应由TiO2制备金属Ti

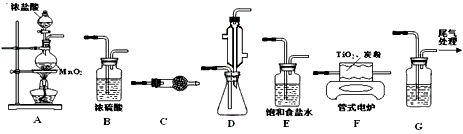
已知:常温下TiCl4是一种极易水解的无色液体,沸点为136.4℃。
①从下列供选用的装置中选择合适的装置制备TiCl4,按气流方向连结起来:
A →______→______→ F →______→______→ G
②下列仪器中盛放的药品分别是C__________;G___________
(4)一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN作溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。称取TiO2样品3.0g,消耗0.2mol/L NH4Fe(SO4)2溶液30mL,则TiO2的质量分数是
____________
参考答案:(1)①Fe;H2O;②TiO2++2H2O=TiO(OH)2+2H+
(2)降温、结晶、过滤
(3)①E、B、D、C;②无水氯化钙;NaOH溶液
(4)80%
本题解析:
本题难度:一般
5、填空题 工业上用重晶石(主要成分BaSO4)为原料制备BaCl2和锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程
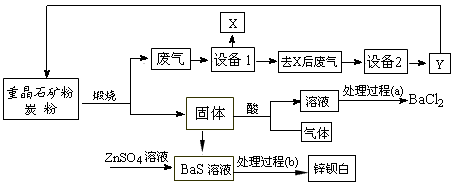
请根据上述流程回答下列问题
(1)假设煅烧时还原产物只有BaS,则反应的化学方程式为___________________________;
(2)设备2中所用的洗涤剂是碱液,则Y的化学式为________________________;
(3)溶解固体所用的酸为____________(写化学式),生成的气体用过量NaOH溶液吸收,其反应的离子方程式为_______________________________;
(4)处理过程(b)的具体步骤为______________________;
(5)锌钡白的成分是___________________(写化学式)。
参考答案:(1)BaSO4+4C 4CO↑+BaS(或BaSO4+2C
4CO↑+BaS(或BaSO4+2C 2CO2↑+BaS)
2CO2↑+BaS)
(2)CO
(3)HCl;2OH-+H2S==S2-+H2O
(4)过滤、洗涤、干燥
(5)BaSO4和ZnS
本题解析:
本题难度:一般