1、选择题 下列实验设计和结论相符的是?(?)
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
C.某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO
D.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
参考答案:D
本题解析:选项A:萃取必须两种溶剂互不溶解,但乙醇能溶解在水中,故错误。选项B:
加热会使氯化铁水解,得不到纯净的氯化铁溶液。选项C:若原溶液含有SO32_,加入稀盐酸
后生成硝酸具有强氧化性,能把亚硫酸根氧化成硫酸根,所以无法判断原溶液一定含有硫酸
根。
点评:本题是对化学综合实验的考查,解题过程中要求考生熟练掌握课本的相关知识,如萃
取操作、除杂操作、离子的检验等。
本题难度:简单
2、选择题 新鲜水果、蔬菜中的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定 法测定某橙汁中维生素C的含量,其化学方程式如下所示.下列说法正确的是
法测定某橙汁中维生素C的含量,其化学方程式如下所示.下列说法正确的是
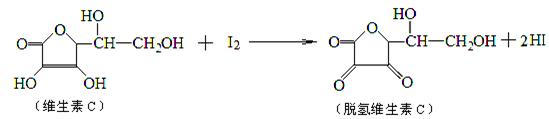
A.上述反应为还原反应
B.滴定时应剧烈振荡锥形瓶
C.滴定时可用淀粉溶液作指示剂
D.滴定时可用酚酞作指示剂
参考答案:C
本题解析:略
本题难度:一般
3、简答题 某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性.请完成对铁元素价态的探究:
①提出合理假设.
假设1:催化剂中铁元素为+3价;假设2:催化剂中铁元素为+2价;
(1)假设3:______.
②设计实验方案.③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是______;
步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设______成立;若出现血红色,则假设______成立;
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现______现象,则假设1成立;反之,则假设3成立.
(5)某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论,该结论是否合理?______(填“是”或“否”),理由是______.
参考答案:(1)铁的氧化物中铁的存在价态有+2、+3价,所以,催化剂中铁元素的价态有三种情况:价态全部为+3价;价态全部为+2价;价态为+3价、+2价,
故答案为:催化剂中铁元素的价态为+3价、+2价;
(2)稀硫酸溶液中溶解氧气,氧气可以氧化亚铁离子,用硫酸溶解氧化物应除去溶解的氧气,防止氧化亚铁离子,故煮沸硫酸的目的是:除去硫酸中溶解的氧气,
故答案为:除去硫酸中溶解的氧气;
(3)Fe3+遇KSCN溶液呈血红色,取A溶液于试管,滴加KSCN溶液,若溶液无明显变化,则说明催化剂中铁元素的价态不含+3价,假设2成立;
若溶液变为血红色,则说明催化剂中铁元素的价态含+3价,假设1或3成立,
故答案为:2;1或3;
(4)若KMnO4溶液的紫红色褪去为无色溶液,则说明催化剂中铁元素的价态含+2价;若不褪色,则说明催化剂中铁元素的价态不含+2价,
故答案为:高锰酸钾溶液紫色不褪去;
(5)硝酸具有强氧化性,加入硝酸会将Fe2+氧化成Fe3+,不能得出该催化剂中铁元素为+3价,
故答案为:否;加入硝酸会将Fe2+氧化成Fe3+.
本题解析:
本题难度:一般
4、简答题 图1是化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图.其中装置Ⅰ为甲同学设计.(可能用到的相对原子质量:H:1?C:12?N:14?O:16?Cu:64?)
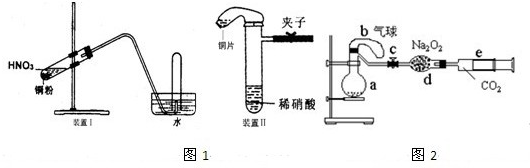
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为______.
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是______.于是他设计装置Ⅱ,其中装铜片的是气球.
(3)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如图2:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶.b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球.(整套装置已经过气密性检查合格.)他们做了以下实验,请填写有关空白:
①将气球中的铜粉小心倒入烧瓶中,充分反应后发现?铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是______;
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是:______;
③打开弹簧夹将二氧化碳慢慢推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳______ml;
④将上述全过程用一个总的化学方程式表示:______.
参考答案:(1)Cu与稀硝酸反应生成硝酸铜、NO和水,发生的离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)装置Ⅰ中利用排水法收集,因为NO2与水反应也可产生NO:3NO2+H2O=2HNO3+NO,故不能肯定生成的NO气体是来自于铜与稀硝酸反应,
故答案为:NO2与水反应也可产生NO:3NO2+H2O=2HNO3+NO,故不能肯定生成的NO气体是来自于铜与稀硝酸反应;
(3)①Cu与硝酸生成硝酸铜溶液,生成NO气体,NO与氧气反应生成二氧化氮,则观察到溶液变蓝色,烧瓶内气体由无色继而变成红色,气球变大,
故答案为:溶液变蓝色,烧瓶内气体由无色继而变成红色,气球胀大;
②气体逐渐减少,氮的氧化物转化为硝酸发生NO2+O2+2H2O═4HNO3、或4NO+3O2+2H2O═4HNO3,
故答案为:NO2+O2+2H2O═4HNO3、或4NO+3O2+2H2O═4HNO3;
③n(Cu)=0.384g64g/mol=0.006mol,由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,被硝酸氧化的Cu为0.01L×1.2mol/L×14×32=0.0045mol/L,
则被氧气氧化的Cu为0.006mol-0.0045mol=0.0015mol,
由2Na2O2+2CO2═2Na2CO3+O2、
4NO+3O2+2H2O=4HNO3,
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
总反应为2Cu+4HNO3+O2═2Cu(NO3)2+2H2O可知,
2Cu~O2~2CO2,n(O2)=0.003mol×22.4L/mol=0.0672L=67.2mL,
a中盛有标况下的空气(氧气占五分之一),烧瓶为250mL,
则氧气占(250-10)×0.25=48mL,
所以参加反应的氧气为67.2mL-48mL=19.2mL,
V(CO2)=2×19.2mL=38.4mL,故答案为:38.4mL;
④上述过程的总反应为2Cu+4HNO3+O2═2Cu(NO3)2+2H2O,故答案为:2Cu+4HNO3+O2═2Cu(NO3)2+2H2O.
本题解析:
本题难度:一般
5、实验题 为探究SO2与可溶性钡盐能否反应生成白色BaSO3沉淀,甲、乙两同学用下图所示装置进行实验(夹持装置、加热装置已略,气密性已检验)
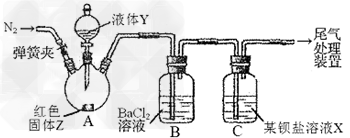
实验操作和现象

(1)A中反应的化学方程式是_________________?。?
(2)C中可溶性钡盐溶液X为_________?。实验过程中,发现液体Y不能很顺利地滴下,则可如何改进:_________。
(3)分析B中不溶于稀盐酸的沉淀的产生原因,甲同学认为是_________,乙同学认为是白雾参与反应。为证实各自的观点,在原实验基础上;甲同学在原有操作之前,先通N2一段时间。乙同学则在A、B间增加盛有饱和NaHSO3溶液的洗气瓶D。 甲、乙各自进行实验,B中现象分别如下表:由此得出的结论是_________。

(4)丙将甲乙两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,但无红棕色气体。C中反应的化学方程式是________________。
(5)丁同学认为丙选择的两种钡盐比较相似,于是丁在丙的基础上将B、C中的钡盐分别换成过量新制的醋酸钡溶液、Ba(AlO2)2溶液,发现B、C中均立即产生大量白色沉淀,该沉淀可溶于稀盐酸,并产生能使澄清石灰水浑浊的气体。C中沉淀为________。实验室里欲获得该沉淀,所需要的玻璃仪器是________________。
(6)结合实验目的,根据四位同学的实验操作和实验现象,你得出的结论是________________________。
参考答案:(1)Cu+2H2SO4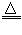 CuSO4+2SO2↑+2H2O
CuSO4+2SO2↑+2H2O
(2)硝酸钡;将分液漏斗改为恒压漏斗(答案合理即可)
(3)空气参与了反应;空气、白雾均是产生白色沉淀的原因,其中白雾是主要原因
(4)3SO2+?2H2O+?3Ba(NO3)2==3BaSO4↓+2NO↑+?4HNO3
(5)BaSO3、氢氧化铝;烧杯、漏斗、玻璃棒
(6)SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀,SO2与可溶性钡的弱酸盐能反应生成BaSO3沉淀
本题解析:
本题难度:一般