1、实验题 利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
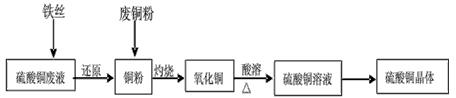
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有___________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是_____,该还原反应的化学方程式是_____________________。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)______________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是____________。
参考答案:(1)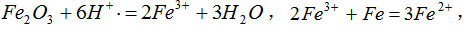
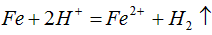
(2)C或CO;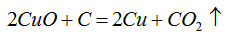
(3)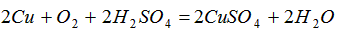
(4)生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2
本题解析:
本题难度:一般
2、实验题 根据硫化氢气体的实验室制法和性质完成下列填空。
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用____________。
a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁 c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器____________(填编号)。

(3)如下图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到的现象是______________________。
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:___________________。 反应过程中,溶液的pH____________(填“变大”、“变小”或“不变”)。
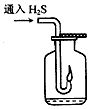
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是________________________。
(6)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是__________________。
参考答案:(1)ad
(2)②③④
(3)品红溶液褪色,瓶壁有淡黄色粉末和无色的小液滴
(4)SO2+2H2S=3S↓+2H2O;变大
(5)b
(6)S、H2O
本题解析:
本题难度:一般
3、实验题 锂离子电池的广泛应用使回收利用锂货源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下
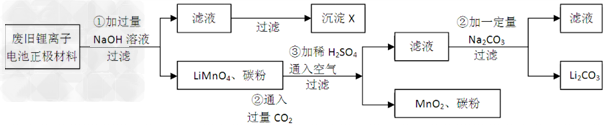
(1)第②步反应得到的沉淀X的化学式为_____________。
(2)第③步反应的离子方程式是______________。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有_________?。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因________、__________。
参考答案:(1)Al(OH)3
(2)4LiMn2O4+O2+4H+=4Li++8MnO2+2H2O
(3)漏斗、玻璃棒 烧杯;滤纸破损;滤液超过滤纸边缘(答案合理即可)
本题解析:
本题难度:一般
4、实验题 某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A (A下端活塞关闭)中。
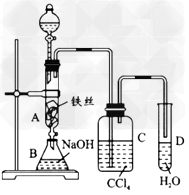
(1)写出A中反应的化学方程式_________________。 ?
(2)观察到A中的现象是_________。 ?
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是___________,写出有关反应的化学方程式_______________。 ?
(4)C中盛放CCl4的作用是_______________。 ?
(5)要证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__________________,现象是______________。
参考答案:(1)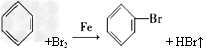
(2)反应液微沸,有红棕色气体充满A容器
(3)除去溶于溴苯中的溴;Br2+2NaOH=NaBr+ NaBrO+H2O(或3Br2+6NaOH=5NaBr+NaBrO3+3H2O)
(4)除去溴化氢气体中的溴蒸气
(5)石蕊试液;溶液变红色(其他合理答案均可)
本题解析:
本题难度:一般
5、实验题 某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用其产物进一步制取FeCl3·6H2O晶体(图中夹持及尾气处理装置均已略去)。

(1)装置B中发生反应的化学方程式为____ 。
(2)装置E中的现象是____ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,将滤液分成两份,分别检验滤液中的金属阳离子。检验Fe3+所用的试剂为___ 检验Fe2+所用的试剂为___。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下
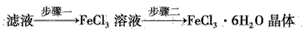
①步骤一中通入足量Cl2发生反应的离子方程式为___。
②步骤二从FeCl3溶液中得到FeCl3·6H2O晶体的主要操作如下(均在HCl气氛中进行): 蒸发、浓缩→冷却、结晶→过滤、洗涤、干燥 在蒸发皿中进行蒸发、浓缩操作时,当____时,应停止加热。此过程应保持盐酸过量的原因是___(用离子方程式表示)。
(5) FeCl3溶液可用于天然气脱硫,写出FeCl3溶液与天然气中的H2S反应的离子方程式:____。
参考答案:(1)3Fe +4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(2)黑色粉末变为红色(试管右侧靠近出气口处有水珠)
(3)KSCN溶液;酸性KMnO4溶液
(4)①2Fe2++Cl2==2Fe3++2Cl- ;②出现少量晶体或晶膜; Fe3+ +3H2O Fe(OH)3 +3H+
Fe(OH)3 +3H+
(5)2Fe3+ +H2S ==2Fe2+ +S↓+2H+
本题解析:
本题难度:一般