|
高考化学试题《物质制备实验方案的设计》高频试题预测(2020年最新版)(八)
2021-02-18 07:00:42
【 大 中 小】
|
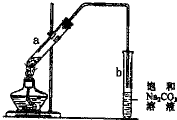
1、选择题 右图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中不正确的是( )
A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加乙酸
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C.制得的乙酸乙酯是一种无色透明、有香味的油状液体
D.向a试管中加入几块碎瓷片的作用是防止加热时液体暴沸
| 
参考答案:A
本题解析:
本题难度:简单
2、实验题 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热 至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。
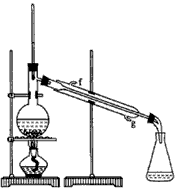
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是_________。
a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了 c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
参考答案:(1)①防暴沸;冷凝;②防止环己烯挥发
(2)①上层;c;②g;冷却水与气体形成逆流;③83℃;b
(3)c
本题解析:
本题难度:一般
3、简答题 “酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示装置制取乙酸乙酯.
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式:______
(2)浓硫酸的作用是:①______;③______
(3)插入右边试管的导气管上接有一个球状容器,其作用为______
(4)将接收液与乙酸乙酯分离的方法是______
(5)做此实验时,有时还向作反应容器的试管里加入几块碎瓷片,其目的是______
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有______(填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
②单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
③混合物中各物质的物质的量相等.
参考答案:(1)乙酸乙酯制取的反应方程式是:CH3COOH+CH3CH2OH 浓硫酸
本题解析:
本题难度:一般
4、实验题 一水硫酸四氨合铜(Ⅱ)的化学式为[ Cu( NH3)4]SO4·H2O,是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
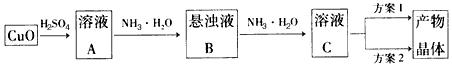
相关信息如下: ①[Cu( NH3)4]SO4·H2O在溶液中存在以下电离(解离)过程:
[ Cu(NH3)4]SO4·H2O=[ Cu( NH3)4]2++SO42-+H2O
[Cu(NH3)4]2+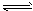 Cu2++4NH3②(NH4)·SO4在水中可溶,在乙醇中难溶。 Cu2++4NH3②(NH4)·SO4在水中可溶,在乙醇中难溶。
③[ Cu( NH3)4]SO4·H2O在乙醇一水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下
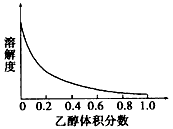
请根据相关信息回答下列问题:
?方案l的实验步骤为: a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥
?(1)①步骤c的抽滤装置如下图所示,该装置中的错误之处是____;抽滤完毕或中途需停止抽滤时,应先______,然后________。
②该方案存在明显缺陷,因为得到的产物晶体中往往含有____杂质,产生该杂质可能的原因是______ 。
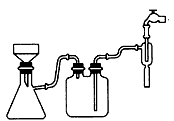
方案2的实验步骤为:
(2)a向溶液C中加入适量______,b_______,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
(3) ②下列选项中,最适合作为步骤c的洗涤液是____。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是__________。
参考答案:(1)①布氏漏斗的颈口斜面未朝向抽滤瓶的支管口;断开连接安全瓶与抽气装置间的橡皮管;关闭抽气装置中的水龙头 ②Cu( OH)2或[Cu2(OH)2SO4];加热蒸发过程中NH3挥发,使反应 [Cu(NH3)4]2+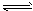 Cu2++4NH3平衡往右移动,且Cu2+水解 Cu2++4NH3平衡往右移动,且Cu2+水解
(2)①乙醇;抽滤(或减压过滤、吸滤)
(3)②C; ③加热易使[?Cu(?NH3)4]SO4·H2O分解(失H2O、失NH3)
本题解析:
本题难度:困难
5、填空题 在试管甲中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
(1)试管乙中盛放的溶液是______.
(2)写出乙醇与乙酸反应的化学方程式______.
(3)实验完成后,试管乙的液面上有透明的不溶于水的油状液体产生.若分离10mL该液体混合物需要用到的主要玻璃仪器是______,这种方法叫做______.
参考答案:(1)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:饱和碳酸钠溶液;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为
CH3COOH+CH3CH2OH
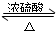
CH3COOC2H5+H2O;
故答案为:CH3COOH+HOCH2CH3

CH3COOCH2CH3+H2O;
(3)分离互不相溶的液体,应采取分液操作,常用的仪器是分液漏斗;
故答案为:分液漏斗,分液.
本题解析:
本题难度:一般
| 