1、选择题 向100 mL0.2mol/L的NaOH溶液中通入标准状况下的CO2448 mL,则最终溶液中粒子间关系不正确的是
A.C(Na+)+C(H+)==C(HCO3—)+C(CO32—)+C(OH—)
B.C(H+)+ C(H2CO3)— C(CO32—) ="=" C(OH—)
C.C(Na+)>C(HCO3—) >C(OH—) >C(H+)>C(CO32—)
D.C(HCO3—) + C(CO32—) + C(H2CO3) ="=" 0.2mol/L
参考答案:A
本题解析:A 错误,电荷不守恒,应在C(CO32—)前加2
B 正确,遵循质子守恒
C 正确,得到是碳酸氢钠溶于,由于碳酸氢跟离子水解,使溶液显碱性
D 正确,遵循物料守恒
本题难度:一般
2、选择题 为了配制CH3COO-与Na+离子物质的量浓度之比为1:1的溶液,可向CH3COONa溶液中加入( )
A.适量的盐酸
B.适量的NaOH固体
C.适量的CH3COOH
D.适量的NaCl固体
参考答案:要使得CH3COO-与Na+离子物质的量浓度之比为1:1,则加入的试剂对平衡CH3COO-+H2O?CH3COOH+OH-起抑制作用即可.
A、加入盐酸会促进醋酸根离子的水解,CH3COO-与Na+离子物质的量浓度之比更小于1:1,故A错误;
B、加氢氧化钠会抑制醋酸根水解,但是引入钠离子,CH3COO-与Na+离子物质的量浓度之比小于1:1,故B错误;
C、加入醋酸固体后,醋酸变浓,水解程度减小,CH3COO-与Na+离子物质的量浓度之比可能接近1:1,故C正确;
D、加入氯化钠固体会增大钠离子的浓度,CH3COO-与Na+离子物质的量浓度之比更加小于1:1,故D错误.
故选C.
本题解析:
本题难度:简单
3、填空题 已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是?,溶液中c(H+)?c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为?,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为?。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH)?c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)?c(H+)(填“>”,“=”或“<”)。
参考答案:(1)CH3COONa ;?< ;?(2)NaOH和CH3COONa;? CH3COOH和CH3COONa, (3)<?>
本题解析:(1)若溶液中只溶解了一种溶质,则该溶质是CH3COONa.由于CH3COONa是强碱弱酸盐。弱酸根离子水解CH3COO-+H2O CH3COOH+OH-,消耗了水电离产生的H+,破坏了水的电离平衡,水会继续电离产生的H+又被消耗,最终当达到电离平衡时,c(H+)<c(OH-)。(2)若溶液中只存在溶质CH3COONa,则由于CH3COO-水解消耗,所以 c(Na+)> c(CH3COO-);Na+、CH3COO-都是盐电离产生的,而OH-、H+都是弱电解质水电离产生的。盐的电离远大于水的电离。则c(CH3COO-)>c(OH-)。这与题意不符。说明溶液中还存在其它的电解质。由于c(OH-)>c(CH3COO-),说明还存在碱NaOH。因此该溶液中的溶质为NaOH和CH3COONa。若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则说明溶液显酸性,含有溶质CH3COOH。由于溶液中c(CH3COO-)>c(Na+),则还有溶质CH3COONa。因此该溶液中的溶质为CH3COOH和CH3COONa。(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,若二者的物质的量相等,则溶液显碱性。性质溶液恰好呈中性,则说明混合前n(CH3COOH)>n(NaOH).由于NaOH是强碱,完全电离,而CH3COOH是弱酸,部分电离,混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)>c(H+)。
CH3COOH+OH-,消耗了水电离产生的H+,破坏了水的电离平衡,水会继续电离产生的H+又被消耗,最终当达到电离平衡时,c(H+)<c(OH-)。(2)若溶液中只存在溶质CH3COONa,则由于CH3COO-水解消耗,所以 c(Na+)> c(CH3COO-);Na+、CH3COO-都是盐电离产生的,而OH-、H+都是弱电解质水电离产生的。盐的电离远大于水的电离。则c(CH3COO-)>c(OH-)。这与题意不符。说明溶液中还存在其它的电解质。由于c(OH-)>c(CH3COO-),说明还存在碱NaOH。因此该溶液中的溶质为NaOH和CH3COONa。若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则说明溶液显酸性,含有溶质CH3COOH。由于溶液中c(CH3COO-)>c(Na+),则还有溶质CH3COONa。因此该溶液中的溶质为CH3COOH和CH3COONa。(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,若二者的物质的量相等,则溶液显碱性。性质溶液恰好呈中性,则说明混合前n(CH3COOH)>n(NaOH).由于NaOH是强碱,完全电离,而CH3COOH是弱酸,部分电离,混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)>c(H+)。
本题难度:一般
4、选择题 物质的量浓度相同的200mL Ba(OH)2溶液和150mL NaHCO3混合后,最终溶液中离子的物质的量浓度关系正确的是
A.c(OH-)>c(Ba2+)>c(Na+)>c(CO32-)
B.c(OH-)>c(Na+)>c(Ba2+)>C(H+)
C.c(OH-)=c(Ba2+)+c(Na+)+c(H+)
D.c(H+)+c(Na+)+2c(Ba2+)=c(OH-)
参考答案:B
本题解析:为了便于计算,设 Ba(OH)2和 NaHCO3的物质的量分别为4mol和3mol,则
n(OH-)="8mol?" n(Ba2+)="4mol?" n(Na+)="3mol?" n(HCO3-)="3mol?" ;反应后:
n(OH-)="5mol?" n(Ba2+)="1mol?" n(Na+)="3mol?" ,所以选B
本题难度:一般
5、选择题 在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示。
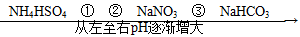
图中①②③可能是( )
A.NH4NO3、(NH4)2SO4、CH3COONa
B.(NH4)2SO4、NH4Cl、C6H5ONa
C.(NH4)2SO4、NH4NO3、Na2CO3
D.(NH4)2SO4、NH4NO3、CH3COONa
参考答案:D
本题解析:(NH4)2SO4溶液中c(NH4+)是NH4NO3溶液中c(NH4+)的2倍,所以(NH4)2SO4溶液中的酸性较强,(NH4)2SO4溶液的pH比NH4NO3溶液的小,A项不符合题意;酸性CH3COOH>H2CO3>  ?>HCO3—,所以同浓度的盐溶液,其pH大小顺序为
?>HCO3—,所以同浓度的盐溶液,其pH大小顺序为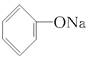 >Na2CO3>NaHCO3>CH3COONa,所以D项符合题意。
>Na2CO3>NaHCO3>CH3COONa,所以D项符合题意。
本题难度:一般