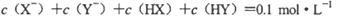1、选择题 已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
下列说法中正确的是(? )
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度,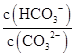 减小
减小
参考答案:C
本题解析:阳离子均为Na+和H+,Na2CO3溶液中Na+浓度是其他两种溶液的两倍,阳离子浓度最大,NaCN溶液和NaHCO3溶液中Na+浓度相等,NaCN溶液中H+浓度小于NaHCO3溶液,故阳离子浓度大小顺序为Na2CO3>NaHCO3>NaCN,A项错误;HCO3-的水解能力小于CN-,故酸性:H2CO3>HCN,B项错误;升高Na2CO3溶液的温度,促进其水解,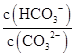 增大,D项错误。
增大,D项错误。
本题难度:一般
2、选择题 下列离子方程式正确的是(?)
A.硫化钠水解 S2-+2H2O H2S+2OH-
H2S+2OH-
B.硫氢化钠的水解 HS-+H2O H3O++S2-
H3O++S2-
C.不断加热煮沸氯化铁溶液 Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
D.硫酸铝溶液跟NaHCO3溶液反应 Al3++3HCO3-=Al(OH)3↓+3CO2↑
参考答案:D
本题解析:A.多元弱酸根离子分步水解,硫化钠水解? S2-+H2O HS― +OH-,?A错误;B.硫氢化钠的水解应为:HS-+H2O
HS― +OH-,?A错误;B.硫氢化钠的水解应为:HS-+H2O H2S+OH―, HS-+H2O
H2S+OH―, HS-+H2O H3O++S2-是电离方程式,B错误;C.不断加热煮沸氯化铁溶液,Fe3+ 会水解完全,生成沉淀,Fe3++3H2O
H3O++S2-是电离方程式,B错误;C.不断加热煮沸氯化铁溶液,Fe3+ 会水解完全,生成沉淀,Fe3++3H2O Fe(OH)3↓+3H+,C错误;D.硫酸铝溶液跟NaHCO3溶液反应? Al3++3HCO3-=Al(OH)3↓+3CO2↑,双水解,D正确;
Fe(OH)3↓+3H+,C错误;D.硫酸铝溶液跟NaHCO3溶液反应? Al3++3HCO3-=Al(OH)3↓+3CO2↑,双水解,D正确;
选D。
本题难度:一般
3、选择题 向三份0.1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
[? ]
A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大
参考答案:A
本题解析:
本题难度:一般
4、简答题 根据Fe3++ Ag  ?Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
?Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
(1)FeCl3溶液显酸性,原因是?(用离子方程式表示)。
(2)关于FeCl3溶液洗银后的相关叙述正确的是?(填序号)。
a.c(Fe3+)减小 b.c(Cl-)不变 c.铁元素质量减小
(3)Fe(NO3)3溶液洗银时,甲同学认为NO3-也能将银氧化。他认为可以通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化,而乙同学认为此方法不?可行,乙同学的理由是?。
(4)乙同学欲从洗银废液(Fe3+、 Fe2+、 Ag+、 NO3-)中回收银和刻蚀液,设计了如下路线:
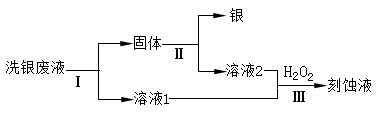
①过程Ⅰ中反应的离子方程式是?。
②过程Ⅱ中加入的试剂可以是?。
(5)镀银后的银氨溶液放置时会析出有强爆炸性的物质,所以不能贮存。从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①生成AgCl沉淀的化学方程式是?。
②若该反应中消耗3.3 g羟氨,理论上可得银的质量为?g。
参考答案:(1)Fe3++3H2O  ?Fe(OH)3+3H+?(2)a
?Fe(OH)3+3H+?(2)a
(3)酸性条件下NO3-也可能与Fe2+发生氧化还原反应?(4)①2Fe3++Fe=3Fe2+?Fe+2Ag+=Fe2++2Ag
②稀盐酸或稀硫酸?(5)①Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O?②10.8
本题解析:(1)FeCl3溶液显酸性是因为铁离子水解生成氢氧化铁和氢离子;反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+;(2)FeCl3溶液洗银,发生反应为:Fe3++Ag?Fe2++Ag+;a.c(Fe3+)减小 故a符合;b. c(Cl-)不变,故b不符合;c.铁元素存在形式不同但质量不会减小,故c不符合;(3)可以通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化;同时注意在酸溶液中,亚铁离子也会反应;(4)①洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液需要先加入过量铁,还原Fe3+、Ag+;反应的离子方程式为:2Fe3++Fe=3Fe2+Fe+2Ag+=Fe2++2Ag;②过程Ⅱ中加入的试剂是溶解过量的铁,可以用稀盐酸或稀硫酸;(5)①银氨溶液中加入过量盐酸生成氯化银,同时生成氯化铵和水,反应的化学方程式为:Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O;②向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.反应为:2AgCl+2NH2OH=N2↑+2Ag+2H2O+2HCl,反应中消耗3.3g羟氨物质的量= =0.1mol,生成银的物质的量0.1mol,质量10.8g。
=0.1mol,生成银的物质的量0.1mol,质量10.8g。
本题难度:困难
5、选择题 今有两种盐的稀溶液,分别是a mol NaX溶液和b mol
NaX溶液和b mol NaY溶液,下列说法不正确的是(? )。
NaY溶液,下列说法不正确的是(? )。
A.若a=b,pH(NaX)>pH (NaY),则相同浓度时,酸性HX>HY
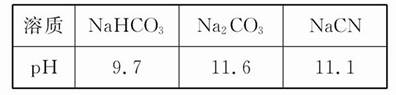
B.若a=b,并测得c(X-)="c" (Y-)+c(HY);则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时, 酸性HX<HY
D.若两溶液等体积混合,测得