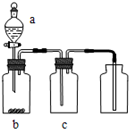
1、实验题 氮及其化合物在生产、生活中有重要的作用。
(1)NH3是制碱工业中不可缺少的重要物质。继侯德榜“联合制碱法”后,上世纪50年代某些化工专家开始研究有机胺制碱法,其工艺流程如下:
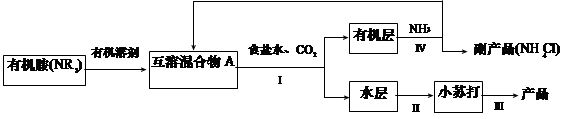
已知:NR3 + CO2 + NaCl + H2O = NaHCO3 + NR3·HCl
NR3 + HCl = NR3·HCl,且NR3·HCl 易溶于有机溶剂。
①操作Ⅰ名称为?;
②某实验小组同学查阅资料知,有机溶剂和有机胺沸点差别较大,现欲将A中各成分进行分离,请写出除了导管、酒精灯、牛角管、锥形瓶外,该分离操作所需的玻璃仪器名称 ?;
(2)N2在化工生产、农业、医疗、航天航空等领域用途广泛。现提供以下装置(连接仪器略去):
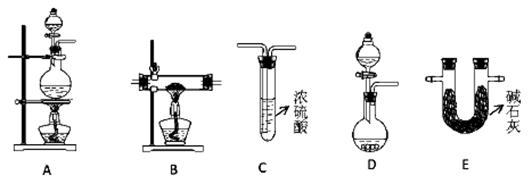
①某化学兴趣小组甲同学欲用加热NaNO2 和NH4Cl的浓溶液制得N2,应该选择的发生装置是?,检验该发生装置气密性的操作为 ?;
②在加热条件下,用NH3 还原CuO可制得N2,同时获得铜粉,此反应的化学方应方程式是?。乙同学用此法制得干燥、纯净的N2,且需要的NH3 以生石灰和浓氨水作原料。按气流从左到右,整套装置的连接顺序是?(填写字母序号);最后一个装置中试剂的作用是??;
参考答案:(1)①分液(2分)
②蒸馏烧瓶、温度计、冷凝管(2分,答对2种得1分,全答对得2分)
(2)①A (2分);关闭分液漏斗下端活塞并将导管连接长导管后置于水中(1分),用酒精灯微热圆底烧瓶,若导管口有气泡冒出,撤掉酒精灯后导管内有一段水柱,则装置气密性好(1分);反之,则装置气密性不好。
②3CuO+ 2NH3 N2+ 3Cu + 3H2O(2分);DEBC(2分);干燥N2(1分)并除去其中的NH3(1分)
N2+ 3Cu + 3H2O(2分);DEBC(2分);干燥N2(1分)并除去其中的NH3(1分)
本题解析:(1)①分离互补相溶液体的方法是分液,所以操作Ⅰ名称为分液。
②有机溶剂和有机胺沸点差别较大,可用蒸馏分离,根据蒸馏的仪器:带铁圈的铁架台,酒精灯,石棉网,蒸馏烧瓶,温度计,冷凝管,牛角管,锥形瓶,因此还缺少蒸馏烧瓶、温度计、冷凝管。
(2)①根据已知信息可知,反应物是亚硝酸钠(NaNO2)和氯化铵的浓溶液混合加热制备氮气,所以需要圆底烧瓶作反应容器,同时还需要加热,因此A装置适合;检验装置气密性的方法一般是利用压强差来进行,所以正确操作是安装好仪器后,关闭分液漏斗下端活塞并将导管连接长导管后置于水中,用酒精灯微热圆底烧瓶,若导管口有气泡冒出。撤掉酒精灯后导管内有一段水柱,则装置气密性好;反之,则装置气密性不好。
②根据原子守恒可知,NH3与CuO反应生成N2、铜和水,所以反应的化学方程式为3CuO+ 2NH3 N2+ 3Cu + 3H2O;需要的NH3 以生石灰和浓氨水作原料,因此需要用D用来制取氨气,氨气是碱性气体,不能用浓硫酸干燥,应该用E装置(碱石灰)干燥氨气。在B中反应后,剩余的氨气可用C装置来除去,同时C装置中的浓硫酸还能干燥氮气。所以按气流从左到右,整套装置的连接顺序是DEBC。
N2+ 3Cu + 3H2O;需要的NH3 以生石灰和浓氨水作原料,因此需要用D用来制取氨气,氨气是碱性气体,不能用浓硫酸干燥,应该用E装置(碱石灰)干燥氨气。在B中反应后,剩余的氨气可用C装置来除去,同时C装置中的浓硫酸还能干燥氮气。所以按气流从左到右,整套装置的连接顺序是DEBC。
本题难度:一般
2、实验题 (10分)实验室常用二氧化锰和浓盐酸反应制取氯气:MnO2+4HCl(浓) MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
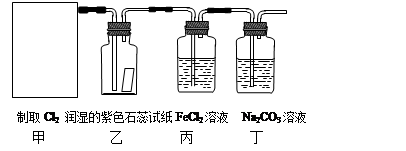
⑴在该实验中,甲部分的装置是?(填写字母)。

⑵乙装置中可观察到的颜色变化为:?。
⑶丙装置中FeCl2溶液与Cl2反应的离子方程式是?。
⑷丁装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是?。
⑸该实验存在明显的缺陷,改进的方法是?。
参考答案:⑴ c?⑵先变红,后褪色 ⑶2Fe2++Cl2 ="==" 2Fe3++2Cl-
⑷Cl2+2Na2CO3+H2O ="==" NaCl+NaClO+2NaHCO3
⑸在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶(合理即得分) (每空2分)
本题解析:(1)甲装置为氯气的制备装置,而氯气的发生装置为“固液加热型装置”,因此选c。
(2)氯气溶于水后能生成盐酸和次氯酸。盐酸具有酸性,可使石蕊试纸变红;而次氯酸具有氧化性,能使红色褪色。因此现象为“先变红,后褪色”。
(3)离子方程式为2Fe2++Cl2 ="==" 2Fe3++2Cl-
(4)根据质量守恒定律可得出方程式如下:Cl2+2Na2CO3+H2O ="==" NaCl+NaClO+2NaHCO3。
(5)氯气是一种有毒气体,不能直接排放到空气中,应将其通入碱溶液中,防止空气污染。
点评:本题以实验题的形式综合考查了氯气的相关知识,属于中档题。考生复习时,应加强对相关知识的联系,形成知识网络系统。
本题难度:一般
3、选择题 右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是
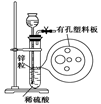
①食盐水?②KNO3溶液?③适量稀硫酸铜溶液
④Na2CO3溶液?⑤CCl4?⑥浓氨水
A.①③⑤
B.①②③
C.④⑤⑥
D.①②③⑤
参考答案:A
本题解析:略
本题难度:一般
4、选择题 实验室常用水吸收氯化氢尾气,以防止环境污染。下列既能吸收尾气,又能防止水倒吸的装置是
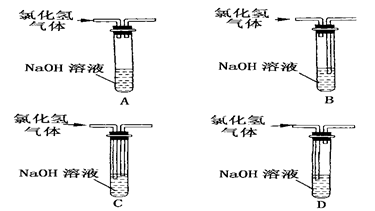
参考答案:B
本题解析:略
本题难度:一般
5、选择题 用图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
A.气体是NO2;a为浓硝酸;b为铜片;c为NaOH溶液
B.气体是SO2;a为浓硫酸;b为Cu;c为酸性品红溶液
C.气体是NH3;a为浓氨水;b为生石灰;c为浓硫酸
D.气体是CO2;a为稀盐酸;b为CaCO3;c为饱和NaHCO3溶液