1、填空题 (14分)实验室中所用少量氯气是用下列方法制取的,
4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:
(1)该反应是氧化还原反应吗??,如果是氧化还原反应,请指出___?是氧化剂,?是还原剂,_________是氧化产物,________是还原产物,根据上述氧化还原反应式判断氧化性:______﹥_______;还原性:______﹥_______。
⑵写出该反应的离子方程式?_________?
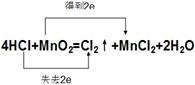
⑶用双线桥法标出该反应电子转移的方向和数目? _______________________________
参考答案:. ⑴?是? MnO2? HCl? Cl2? MnCl2?MnO2﹥Cl2? HCl﹥MnCl2
(2)4H++2Cl-+MnO2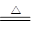 Cl2↑+Mn2++2H2O
Cl2↑+Mn2++2H2O
(3) 
本题解析:(1)根据反应的方程式可知,氯元素的化合价从-1价升高到0价,而锰元素的化合价从+4价降低到+2价,所以属于氧化还原反应。其中氧化剂是二氧化锰,HCl是还原剂。氯气是氧化产物,而氯化镁是还原产物。由于在氧化还原反应中氧化剂的氧化性强于氧化产物的,还原剂的还原性强于还原产物的,所以氧化性和还原性强弱顺序分别是MnO2﹥Cl2、HCl﹥MnCl2。
(2)氯化氢和氯化锰都是可以拆开的,所以该反应的离子方程式是
4H++2Cl-+MnO2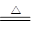 Cl2↑+Mn2++2H2O。
Cl2↑+Mn2++2H2O。
(3)双线桥中起点和终点的元素是同一种,所以该氧化还原反应的表示是
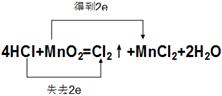
点评:在进行氧化还原反应的有关判断时,关键时准确标出有关元素的化合价变化情况,然后依据有关的概念进行分析判断即可。
本题难度:一般
2、选择题 下列反应方程式中有一个与其它三个在分类上不同,这个反应是
A.2Mg + O2 2MgO
2MgO
B.Zn +2HCl = ZnCl2 + H2↑
C.NaCl + AgNO3= AgCl↓+ NaNO3
D.CuO + H2 Cu + H2O
Cu + H2O
参考答案:C
本题解析:正确选项为C,该反应为复分解反应属于非氧化还原反应,其他三个选项为氧化还原反应;
本题难度:一般
3、选择题 下列叙述中正确的是( )
A.有单质生成的反应一定是氧化还原反应
B.非金属的最高价含氧酸都具有强氧化性
C.两种不同的阴离子在溶液中一定能大量共存
D.同种物质中的同种元素在反应中可能既被氧化又被还原
参考答案:D
本题解析:A不正确,例如氧气生成臭氧等;B不正确,例如碳酸等;C不正确,例如OH-和HCO3-等,因此正确的答案选D。
本题难度:一般
4、填空题 (12分)已知反应:①SO3+H2O===H2SO4、②3NO2+H2O===2HNO3+NO
③2F2+2H2O===4HF+O2、④2Na+2H2O===2NaOH+H2↑、
⑤Na2O+2HCl===2NaCl+H2O、⑥SiO2+2NaOH===Na2SiO3+H2O
(1)上述反应中不属于氧化还原反应的有______________________ (填序号,下同).
H2O被氧化的是______,H2O被还原的是______.属于氧化还原反应,但其中的H2O既不被氧化又不被还原的是__________________.
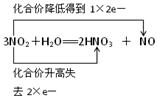
(2) 用双线桥分析反应②:______________________________________________.
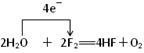
(3) 用单线桥标出反应③的电子转移方向和数目_________________________.
(4)写出反应④的离子方程式:______________________________________________.
参考答案:(12分)
(1)①⑤⑥ (填序号,下同). ③、? ④、? ②.
(2)
 (3)
(3)
(4)? 2Na+2H2O===2Na++2OH-+H2↑
本题解析:(1)根据方程式可知,①⑤⑥中元素的化合价都没有变化,不是氧化还原反应。而在反应②中,氮元素的化合价部分升高到+5价,部分降低到+2价,因此NO2既是氧化剂,也是还原剂,而水既不是氧化剂,也不是还原剂;反应③F元素的化合价从0价降低到-1价,单质氟是氧化剂。而水中氧元素的化合价从-2价升高到0价,失去电子,作还原剂;反应④中,钠元素的化合价从0价升高到+1价,失去电子。水中氢元素的化合价从+1价降低到0价,导电得到电子,作氧化剂。
(2)双线桥法:表示同种元素的原子在反应前后转移电子的情况,箭头从反应物指向产物,但并不表示电子转移的方向,桥两端连接同种元素,因此应该表示为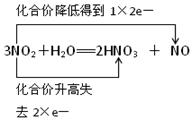 。
。
(3)单线桥中箭头从还原剂中失电子的元素指向氧化剂得电子的元素,由于箭头的方向已经指明电子转移的方向,所以不需要注明得失,但必须注明电子转移的数目。即应该表示为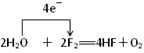 。
。
(4)根据化学方程式可知,该反应的离子方程式是2Na+2H2O===2Na++2OH-+H2↑。
点评:凡是有元素化合价升降的反应都是氧化还原反应,没有元素化合价升降的反应是非氧化还原反应,所以判断氧化还原反应的关键是准确判断元素的化合价变化。
本题难度:一般
5、选择题 某稀溶液中含有等物质的量的(均为1mol)ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁粉。下列各图表示溶液中的Fe2+的物质的量与加入铁粉的物质的量之间的关系,其中正确的是(? )
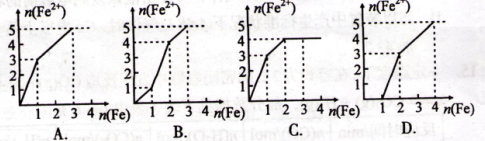 ?
?
参考答案:A
本题解析:加入铁粉后发生的离子反应的顺序为:Fe+2Fe3+= 3Fe2+,n(Fe):n(Fe2+)=1:3;再发生反应:Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2+ +H2↑, n(Fe):n(Fe2+)=l:1,所以答案A正确。
本题难度:一般