1、实验题 甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/?盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
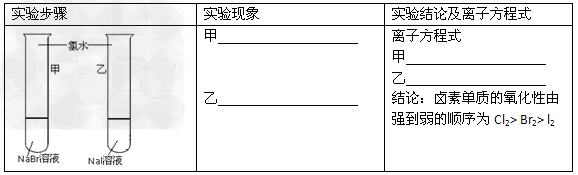
【评价】甲同学设计的实验方案的合理性是___________(填序号)
A.?非常合理 B.?部分合理 C.?完全不合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素

甲同学所得实验依据和结论有明显问题,问题是__________。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
①
②电极反应式 ____________________________、____________________________
参考答案:(1) B;溴水
B;溴水
(2)锌粉的表面积大,也能加快反应速率 ?
(3)“略”
本题解析:
本题难度:一般
2、选择题 下列不同条件下的化学反应A+B=C+D,反应速率按由大到小的顺序排列,正确的一组是
[? ]
①常温下20 mL含A和B各0.001 mol
②常温下100 mL含A和B各0.01 mol
③常温下0.05 mol/L的A,B溶液各10 mL,再加入蒸馏水20 mL
④常温下100 mL含A 0.01 mol和20 mL 含B 0.001 mol
A.①②③④
B.④③②①
C.②④①③
D.②①④③
参考答案:C
本题解析:
本题难度:一般
3、选择题 化学中常用图象直观地描述化学反应的进程或结果,下列图象描述正确的是( )

A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,且乙的压强大
C.图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系
D.根据图④可确定除去CuSO4溶液中的Fe3+可以向溶液中加入Cu(OH)2调节pH至4左右
参考答案:A、升高温度时,无论该反应是放热反应还是吸热反应,正逆反应速率都增大,不是一个增大一个减小,故A错误;
B、从图象可知,乙曲线斜率大,乙反应到达平衡用得时间少,则乙反应速率快,根据压强对反应速率的影响,压强越大反应速率越大,则乙曲线压强大,该反应是一个反应前后气体体积不变的化学反应,增大压强平衡不移动只是增大正逆反应速率,缩短到达平衡的时间,所以A的含量不变,符合实际,故B正确.
C、镁离子和铝离子都与氢氧根离子反应生成氢氧化镁和氢氧化铝沉淀,但氢氧化钠过量时,氢氧化铝又和氢氧化钠反应生成可溶性的偏铝酸钠,导致部分沉淀溶解,沉淀的量减少,当氢氧化铝完全转化为偏铝酸钠后,沉淀的量不再减少是一个恒定值,故C错误;
D、CuSO4溶液中加入适量Cu(OH)2,发生:Cu(OH)2+2H+═Cu2++2H2O,溶液中H+浓度减小,易于Fe3+水解生成沉淀,当调节pH在4左右时,Fe3+全部水解生成沉淀而除去,故D正确.
故选BD.
本题解析:
本题难度:简单
4、填空题 某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)  2SO3(g),ΔH < 0的正、逆反应速率的影响如图所示:
2SO3(g),ΔH < 0的正、逆反应速率的影响如图所示:

(1)加催化剂对反应速率影响的图像是________(填序号,下同),平衡________移动。
(2)升高温度对反应速率影响的图像是________,平衡向________方向移动。
(3)增大反应容器体积对反应速率影响的图像是________,平衡向________方向移动。
(4)增大O2的浓度对反应速率影响的图像是__________,平衡向________方向移动。
参考答案:(1)C?不?(2)A?逆反应?(3)D?逆反应?(4)B?正反应
本题解析:(1)加入催化剂,正逆化学反应速率同等程度的加快,化学平衡不移动;(2)升高温度,化学反应速率都离开原来的速率点迅速加快,化学平衡向着吸热方向进行,即向着逆方向进行,逆反应速率快于正反应速率;(3)增大反应容器体积相当于减小压强,此时正逆反应速率都迅速减慢,化学平衡向着气体体积增大的方向即向着逆方向进行,正反应速率慢于逆反应速率,(4)增大反应物氧气的浓度,正逆化学反应速率加快,化学平衡向着正反应方向进行,逆反应在原来基础上加快,正反应速率迅速加快,且快于逆反应速率。
本题难度:一般
5、选择题 下列关于化学反应速率的说法正确的是
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学平衡指化学反应的最大限度,改变条件也不能改变化学平衡
C.可逆反应达到化学平衡状态时,正、逆反应的速率都为0
D.升高温度一定能增大反应速率