1、选择题 工业生产硫酸时,其中一步反应是2SO2 + O2 ?2SO3,下列说法错误的是(? )
?2SO3,下列说法错误的是(? )
A.增大氧气的浓度可提高反应速率
B.升高温度可提高反应速率
C.使用催化剂能显著增大反应速率
D.达到化学平衡时正逆反应速率相等且都为零
参考答案:D
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以选项D是错误的,其余都是正确的,答案选D。
本题难度:一般
2、选择题 在可逆反应中,加入催化剂的作用是(?)
A.改变正、逆反应速率,但改变的程度不同
B.提高反应物达到平衡时的转化率
C.缩短到达平衡所用的时间
D.提高生成物在平衡体系中的质量分数
参考答案:C
本题解析:催化剂能同等程度地改变正、逆反应速率,不能使化学平衡发生移动。
本题难度:简单
3、实验题 已知氯水中有如下平衡:Cl2+H2O HCl+HClO。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸人40mLCl2和10mL H2O。
HCl+HClO。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸人40mLCl2和10mL H2O。
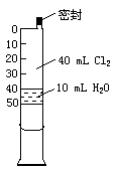
(1)针筒中可观察到的现象是________________。
(2)若将此针筒长时间放置在有日光的地方,最终可能观察到的现象是________________。
(3)用化学平衡的观点解释(2)的现象:________________。
参考答案:(1)气体体积缩小,溶液呈浅黄绿色;
(2)气体和溶液均变无色,气体体积略小于20mL。
(3)氯水中有平衡Cl2+H2O HCl+HClO,因HClO见光分解,平衡不断右移,最终Cl2耗尽而全部转化为O2,且v(O2)=
HCl+HClO,因HClO见光分解,平衡不断右移,最终Cl2耗尽而全部转化为O2,且v(O2)= v(Cl2)=20mL,但由于O2在水中有一定溶解度,故v(O2)略小于20mL。
v(Cl2)=20mL,但由于O2在水中有一定溶解度,故v(O2)略小于20mL。
本题解析:正确分析出该装置中所发生的物理化学变化,然后运用外界条件对化学平衡移动的影响来解释。其中主要化学变化为:Cl2+H2O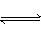 HCl+HClO,2HClO
HCl+HClO,2HClO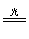 2HCl+O2↑。
2HCl+O2↑。
本题难度:一般
4、选择题 下列措施可以提高燃料的燃烧效率的是?
[? ]
①提高燃料的着火点?②降低燃料的着火点?③将固体燃料粉碎?
④将液体燃料雾化?⑤将煤气化处理?
A.①③④⑤?
B.②③⑤ ?
C.③④⑤?
D.①②③④
参考答案:C
本题解析:
本题难度:简单
5、选择题 镁粉与一定量某浓度的盐酸反应,但反应速度太快,为减慢反应速度,且不影响产生H2的总量,可向盐酸中加入的物质是(?)
A.Na2CO3
B.CH3COONa
C.NaOH
D.NaHCO3
参考答案:B
本题解析:ACD都会消耗氢离子,反应速率降低,但产生的氢气会减少。醋酸钠能结合氢离子,生成难电离的醋酸,反应速率降低。随着反应的进行,醋酸再电离出氢离子,从而使产生的氢气不变,答案选B。
本题难度:一般