1、选择题 已知胆矾溶于水时,溶液温度降低。在室温下将1mol无水硫酸铜制成溶液时,放出热量为Q1kJ,而胆矾分解的热化学方程式是CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q2kJ/mol,则Q1与Q2的关系是
[? ]
A.Q1>Q2
B.Q1=Q2
C.Q1<Q2
D.无法确定
参考答案:C
本题解析:
本题难度:一般
2、计算题 (1)已知含11.2g KOH的稀溶液与1L0.1mol·L-1的H2SO4稀溶液反应放出11.46 KJ的热量。请写出KOH的稀溶液与的H2SO4稀溶液发生中和反应,表示中和热的热化学方程式为___________________________
(2)在相同条件下,下列两个反应的反应热分别为△H1和△H2表示:
①2H2(g)+O2(g)==2H2O(g)△H1,
②2H2(g)+O2(g)==2H2O(l)△H2,
则△H1和△H2的关系为__________________
参考答案:(1)KOH(aq)+1/2H2SO4(aq)==1/2K2SO4(aq)+H2O(l), =-57.3kJ/mol
=-57.3kJ/mol
(2)△H1 >△H2
本题解析:
本题难度:一般
3、填空题 (共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为 。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________
参考答案:(1)①N2H4(l)+2H2O2(l) = N2(g) +4H2O(g) △H=-644.25 KJ/mol (3分)
② 410.125 (3分)
③产物不会造成环境污染。(3分)
(2)CO(g)+FeO(s) ="=" Fe(s)+CO2(g) △H=
本题解析:
本题难度:一般
4、选择题 通常人们把拆开某化学键所吸收的能量看成该化学键的键能,键能的大小可用于估算化学反应的 反应热△H(化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之 和的差)。一些化学键的键能数据如下。 下列热化学方程式正确的是

[? ]
A.1/2N2(g)+3/2H2(g)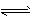 NH3 (g) △H=-421.9 kJ·mol-1
NH3 (g) △H=-421.9 kJ·mol-1
B.N2(g)+3H2(g)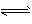 2NH3 (g) △H = -620. 8 kJ·mol-1
2NH3 (g) △H = -620. 8 kJ·mol-1
C.NH3(g)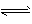 1/2N2(g)+3/2H2(g) △H = +45.4 kJ·mol-1
1/2N2(g)+3/2H2(g) △H = +45.4 kJ·mol-1
D.N2 (g) +3H2 (g)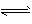 2NH3( g) △H=-45.4 kJ·mol-1
2NH3( g) △H=-45.4 kJ·mol-1
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列有关热化学方程式的评价合理的是( ? )
| ? | 实验事实 | 热化学方程式 | 评价
A | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1,将稀硫酸与 稀氢氧化钡溶液混合 | H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)
△H=-114.6 kJ?mol-1 | ?
正确
B | 稀醋酸与稀氢氧化钠溶液混合 | CH3COOH(aq)+NaOH(aq)=NaCl(aq)+H2O(l)
△H=-57.3k J?mol-1 | 不正确;因为醋酸状态为“l”,而不是“aq”.
C | 160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ | SO3(g)+H2O(l)=H2SO4(aq)△H=-130.3 kJ?mol-1 | 不正确;因为反应热为△H=-260.6 kJ?mol-1
D | 已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ | C(s)+O2(g)=CO2(g)
△H=-393.51 kJ?mol-1 | 不正确;同素异形体要注名称:C(石墨,S)
|