1、填空题 实验:
(1)(4分)右图为实验室某浓盐酸 试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

①该浓盐酸中HCl的物质的量浓度为_________mol·L-1。
②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________ 。
A.溶液中HCl的物质的量? B.溶液的浓度?
C.溶液中Cl-的数目? D溶液的密度
(2).(8分)实验室配制480mL0.08mol/LNa2CO3溶液回答下列问题
①应用托盘天平称取十水碳酸钠晶体_______g
② 若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
③用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是?
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
④若实验遇下列情况,溶液的浓度是“偏高”、“偏低”还是“不变”?
A.加水时越过刻度线_________
B.忘记将洗涤液加入容量瓶_________ _
_
C.容量瓶内壁附有水珠而未干燥处理____________
D.溶解后没有冷却便进行定容____________ __
__
(3)(8分)①取少量Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式为______________,反应后得到黄色的FeCl3溶液。用此溶液做以下实验:
②取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成, 反应的离子方程式为____________________________________。
反应的离子方程式为____________________________________。
③在小烧杯中加入25 mL蒸馏水,加热至沸腾后,向沸水中加入2 mL FeCl3饱和溶液,继续煮沸至溶液呈________色,即可制得Fe(OH)3胶体。
④另取一小烧杯加入25 mL蒸馏水后,向烧杯中再加入2 mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到________(填甲或乙)烧杯中会产生丁达尔效应。此实验可以区别?
? ?
?
参考答案:(1)① 11.9;②BD (2)①11.4;②10.6;③B④?偏低、偏低、不变、偏高(3)①Fe2O3 +6H+ = 2Fe3+ ?+ 3H2O②? Fe3+ + 3O H- = Fe(OH)3↓③红褐④乙;溶液和胶体
H- = Fe(OH)3↓③红褐④乙;溶液和胶体
本题解析:略
本题难度:简单
2、填空题 (9分)有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:①X与Z、Y与W分别同主族;②X、Z、W分别与Y都能形成两种常见的化合物;③Y的阴离子与Z的阳离子核外电子排布相同,试根据以上叙述填空:
(1)写出由Y与Z形成的化合物Z2Y2的电子式:?,WY2与X2Y2反应生成粘稠油状液体的化学方程式:?。
(2)有两种化合物都只含上述四种元素,它们在水溶液中发生反应生成气体的离子方程式为:?。
(3)X、Y两种元素的单质已经被应用于飞船的燃料电池中,如图所示,两个电极都由多孔性碳构成,通入的两种单质由空隙逸出并在电极表面放电。
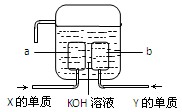
①a是装置的?极。
②b极上的电极反应式是?。
参考答案:(9分)
⑴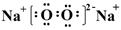 ? H2O2 + SO2 = H2SO4
? H2O2 + SO2 = H2SO4
⑵H+ + HSO3— = H2O + SO2↑
⑶负(1分)? O2 + 2H2O + 4e— = 4OH—
本题解析:X、Z、W分别与Y都能形成两种常见的化合物是本题推断元素的主要突破点:这两种常见的化合物分别为H2O、H2O2、Na2O、Na2O2。所以四种元素分别为:H、O、Na、S。
(3)组成了氢氧碱性燃烧电池,其中通入氢气的一方为负极,失电子:H2 +2e—+2OH— = 2H2O!通往氧气的一方为正极,得电子:O2 + 2H2O + 4e— = 4OH—;
本题难度:一般
3、推断题 将一定量的晶体A隔绝空气加热至200℃,A完全分解生成等物质的量的四种气体。这四种气体具有如图所示的转化关系:

已知:F、H是中学化学中常见的单质;L是一种红棕色气体(图中部分产物和条件未列出)。
(1)写出过氧化钠的电子式:___________;B的结构式为___________
(2)写出D与H高温反应的化学方程式:____________________
(3)写出H与足量的M稀溶液反应的离子方程式:___________________________
(4)A的化学式为____________
参考答案:(1)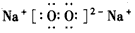 ;
;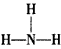 (2)4H2O(g)+3Fe
(2)4H2O(g)+3Fe Fe3O4+4H2
Fe3O4+4H2
(3)Fe+4H++NO3-=Fe3++NO↑+2H2O
(4)NH4HC2O4
本题解析:
本题难度:一般
4、推断题 下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。 常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上 的重要反应。
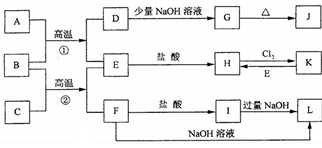
请回答下列问题:
(1)D的电子式为____。
(2)K的化学式为____。
(3)写出B与C高温反应生成E和F的化学方程式:___。
(4)写出D与J的稀溶液反应生成G的离子方程式___。
参考答案:(1) 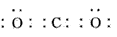
(2)FeCl3
(3)Fe2O3+2Al Al2O3+2Fe
Al2O3+2Fe
(4)CO2+CO32-+H2O==2HCO3-
本题解析:
本题难度:一般
5、推断题 如图所示,A、B、C、D、E、F、G、H、I、J 10种物质是中学化学中常见的物质,在一定条件下相互转化,A 是原子半径最小的元素形成的气体单质,C是能使红色石蕊试纸变蓝的气体,J溶液呈蓝色,反应①②③为重要的工业反应,G的相对分子质量是F的两倍。B、C、E、 F、G、H、J中含有一种相同的元素。
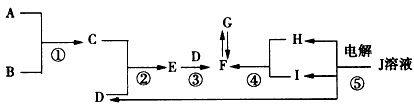
(1)写出B分子的结构式:_____________________。
(2)写出电解J溶液的化学方程式:_______________。
(3)C与H反应生成的化合物中所含化学键的类型是_______________。
(4)气体F、G混合呈____色,将混合气体置于注射器中,将活塞迅速向外拉到一定位置,可观察到_________________________。
参考答案:(1) N N
N
(2)2Cu(NO3)2+2H2O 2Cu+O2↑+4HNO3
2Cu+O2↑+4HNO3
(3)共价键、离子键
(4)红棕;气体颜色先变浅再变深
本题解析:
本题难度:一般