1、选择题 能鉴别Mg、AgNO3、Na2CO3、NaAlO2四种溶液的试剂是
A.HNO3
B.KOH
C.BaCl2
D.NaClO
参考答案:A
本题解析:略
本题难度:简单
2、实验题 某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质。某小组在实验室中用浸出-萃取法制备硫酸铜:
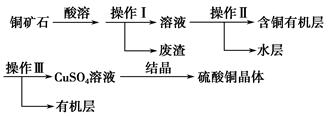
(1)操作Ⅰ为________。操作Ⅱ用到的玻璃仪器有烧杯、________。
(2)操作Ⅱ、操作Ⅲ的主要目的是________、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80 ℃、200 ℃、300 ℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2? mol·L-1盐酸、1 mol·L-1 H2SO4、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1 BaCl2溶液、蒸馏水。仪器和用品自选。
实验步骤
| 预期现象和结论
|
步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,______________________
| ____________,说明悬浊液中混有Cu4(OH)6SO4
|
步骤2:另取少量悬浊液于试管中,____________________
| ____________,说明悬浊液中混有Cu(OH)2
|
?
(4)上述实验需要100 mL 0.5? mol·L-1的CuSO4溶液,配制时需称取________g CuSO4·5H2O(相对分子质量:250)。
参考答案:(1)过滤 分液漏斗
(2)除去杂质
(3)
实验步骤
预期现象和结论
加入过量2 mol·L-1盐酸,充分振荡,再滴加几滴0.1 mol·L-1 BaCl2溶液
有白色沉淀生成
将试管放入装有沸水的小烧杯中水浴加热一段时间,取出试管观察
试管中有黑色固体生成
?
(4)12.5
本题解析:(1)由流程图可知操作Ⅰ是固、液分离,是过滤;操作Ⅱ是液液分离,且互不相溶,是分液,用到分液漏斗。(2)操作Ⅱ、Ⅲ的目的主要是除杂。
步骤1,由信息中三种物质均难溶于水,可溶于酸,故加入过量盐酸使之溶解,再用BaCl2溶液检验有无SO42—即可。步骤2,检验有无Cu(OH)2,可利用信息中三种物质分解温度不同,可在80 ℃时看有无分解产生CuO,若有,则有Cu(OH)2。(4)配制溶液需CuSO4的物质的量为0.1 L×0.5 mol·L-1=0.05 mol,即需要0.05 mol CuSO4·5H2O,其质量m=0.05 mol×250 g
·mol-1=12.5 g。
本题难度:一般
3、选择题 除去下列物质中少量杂质的方法正确的是(?)
A.除去FeCl2溶液中混有的FeCl3加入过量铁粉,过滤
B.除去NO2中混有的NO:用水洗气
C.除去SO2中混有的HCl:用饱和亚硫酸钠溶液洗气
D.除去Cu粉中混有的Cu0:加适量稀硝酸后,过滤、洗涤
参考答案:A.
本题解析:
试题解析:B错误,NO2与水反应。C.除去SO2中混有的HCl可用饱和亚硫酸氢钠溶液洗气。D,Cu与稀硝酸反应。
本题难度:一般
4、选择题 下列分离方法不正确的是( )
A.用过滤的方法除去食盐水中的泥沙
B.用酒精萃取碘水中的碘
C.用蒸馏的方法将自来水制成蒸馏水
D.用结晶法提纯有少量氯化钾的硝酸钾
参考答案:A、泥沙不溶于水,氯化钠溶于水,可以用过滤的方法除去食盐水中的泥沙,故A正确;
B、酒精和水是互溶的,不能用酒精作为萃取碘水中的碘的萃取剂,故B错误;
C、蒸馏的方法可以将自来水中的水蒸发出来,制成蒸馏水,故C正确;
D、氯化钾和硝酸钾的溶解度随温度变化不同,二者的分离可以采用结晶法,故D正确.
故选B.
本题解析:
本题难度:一般
5、选择题 现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下
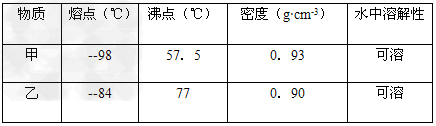
据此,将甲和乙相互分离的最佳方法是?
[? ]
A、萃取法?
B、过滤法?
C、蒸馏法?
D、分液法
参考答案:C
本题解析:
本题难度:简单