1、选择题 下列化学原理表述正确的是
[? ]
A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大
B.Na2CO3溶液中满足:c(?Na+)==2c(CO32-)+2c(HCO3-?)+2c(H2CO3)
C.NaHCO3溶液不显中性的原因:HCO3-?+H2O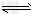 CO32-?+H3O+
CO32-?+H3O+
D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速度快,生成H2的物质的量多
参考答案:B
本题解析:
本题难度:一般
2、填空题 (1)0.020mol/L的HCN(aq)与0.020mol/L NaCN(aq)等体积混合,已知该混合溶液中c[Na+]>
c[CN-],用“>、<、=”符号填空
①溶液中c[OH-]__________c[H+] ②c[HCN]_________c[CN-]
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:(A) 逐渐减小; (B) 逐渐增大; (C) 先逐渐增大,而后减小;(D) 先逐渐减小,而后增大。你的选择是__________
(3)pH值相同的 ①HCl(aq)、 ②H2SO4(aq)、 ③CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是__________(化学式)。
②分别用0.1 mol/L的NaOH(aq)中和,其中消耗NaOH(aq)最多的是(化学式)__________。
③分别投入足量大小相同的锌粒,反应开始时,反应速率__________。
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
(4)某温度下,纯水中的c[H+] = 2.0×10-7mol/L,则此时c(OH-)=__________mol/L。相同条件下,测得
① NaHCO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是_________________。
(5)25℃时, 0.05mol/LH2SO4溶液的PH=_________;0.05mol/LBa(OH)2溶液C(H+)=_______ mol/L
参考答案:(1)① >;② >
(2)C
(3)①CH3COOH(aq);② CH3COOH(aq);③ D
(4)2.0×10-7mol/L;②①③
(5)1;1×10-13
本题解析:
本题难度:一般
3、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是?
[? ]
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)?=?c(HRO3-)?+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③NH4HSO4三种溶液中c(NH4+):③<②<①?
D.相同条件下,pH=5的①NH4C1溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是
[? ]
A.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中
c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)
B.在0.1 mol/L NaHSO3溶液中有
c(Na+)=c(HSO3-)+c(SO32-)
C.0.1 mol/LK2HPO4和0.2 mol/L KH2PO4的混合溶液中:
c(K+)+c(H+)=c(H2PO4-)+ 2c(HPO42-)+3c(PO43-)+c(OH-)
D.0.2 mol/L的NaHCO3溶液:
c(HCO3-)>c(CO32-) >0.1 mol/L>c(H2CO3)
参考答案:C
本题解析:
本题难度:一般
5、填空题 (1)有一种溶液除H+、OH-外,还有Na+、SO42- 和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1、 0.004 mol·L-1,该溶液的pH为________;
(2)向NH4Cl溶液加入少量石蕊,溶液显________色,请用离子方程式写出产生该现象的原因:______;
(3)液氨类似于水的电离,试写出液氨的电离方程式________,在液氨中加入NH4Cl,则平衡_________移动(选填“向左”或“向右”);
(4)pH相同的氨水和氢氧化钠,分别用蒸馏水稀释至原来溶液的100倍,则稀释后两种溶液的pH分别为m和n,则m______n(填“>”“<”或“=”);
(5)在0.1 mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为:
c(Na+)>c(HSO3-)>c(SO32- )>c(H2SO3)。则溶液中c(H+)__________c(OH-) (填“<”“>”或“=”);往该溶液中滴加过量的氢氧化钡,可观察到的现象是__________; 写出该反应的离子方程式__________。
参考答案:(1) 3
(2)红 ;NH4++H2O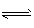 NH3·H2O+H+
NH3·H2O+H+
(3) 2NH3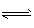 NH4++NH2-? ;向左
NH4++NH2-? ;向左
(4)>
(5)> ;有白色沉淀产生 ;HSO3-+Ba2+ +OH-=BaSO3↓+H2O
本题解析:
本题难度:一般