1、选择题 元素X、Y和Z可结合形成常见化合物XYZ3,X、Y和Z的原子序数之和为26,Y和Z在同一周期。下列有关推测正确的是
[? ]
A.若XYZ3是一种可溶于水的酸,则Y是氯元素
B.XYZ3是一种易溶于水的盐,且X与Z可形成共价化合物
C.XYZ3是一种微溶于水的盐,且Y与Z可形成共价化合物
D.若XYZ3是一种盐,则Y一定是硫元素
参考答案:C
本题解析:
本题难度:一般
2、填空题 下表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
(1)f元素在周期表中的位置是第______周期第______族.
(2)e?与f两元素最高价氧化物的水化物相互反应的化学方程式为______
(3)e在空气中燃烧的产物所含化学键的类型为______、______.
(4)化合物ca3的电子式为______,c和d两种元素氢化物的稳定性更强的是______(填物质的化学式).
参考答案:根据元素所在周期表中的位置可知a为H元素,b为C元素,c为N元素,d为O元素,e为Na元素,f为Al元素,g为元素,
(1)f为Al元素,原子序数为13,位于周期表第三周期IIIA族,故答案为:三、IIIA;
(2)e?与f两元素最高价氧化物的水化物分别为NaOH和Al(OH)3,Al(OH)3为两性氢氧化物,
反应的方程式为NaOH+Al(OH)3=NaAlO2+2H2O,
故答案为:NaOH+Al(OH)3=NaAlO2+2H2O;
(3)e在空气中燃烧的产物Na2O2,含有离子键和共价键,故答案为:离子键、共价键;
(4)化合物ca3为NH3,为共价化合物,电子式为
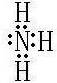
,c和d两种元素中d的非金属性较强,则对应的氢化物的稳定性更强,故答案为:H2O.
本题解析:
本题难度:简单
3、填空题
下列分子的结构:CO2,PCl3,CCl4,NO2,Na2O2,NaOH,其中原子的最外层不能都满足8电子稳定结 构的是_______;是离子化合物,且离子个数之比为2:1的是__________;只有极性键的是__________;既有离子键,又有极性键的是___________,既有离子键,又有非极性键的是___________。
参考答案:NaOH、Na2O2;Na2O2;CO2、PCl3、CCl4、NO2;NaOH;Na2O2
本题解析:
本题难度:一般
4、选择题 最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N N放出942 kJ热量,根据以上信息和数据,下列说法正确的是(?)
N放出942 kJ热量,根据以上信息和数据,下列说法正确的是(?)

A.N4属于一种新型的化合物
B.N4与N2互称为同位素
C.N4化学性质比N2稳定
D.1 mol N4气体转变为N2将放出882 kJ热量
参考答案:D
本题解析:N4是单质不是化合物,A错。同位素是原子间的互称,N4和N2都是分子不能互称同位素,B错。根据键能判断N4=2N2为放热反应,所以N2稳定,C错。1mol N4气体转变为N2将放出的热量=|167kJ×4-2×942kJ|=882kJ,D对。所以选D。
点评:这是一道综合性很强的题,难度比较大,尤其是计算反应热的时候,容易出错。
本题难度:一般
5、选择题 2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2的键能为942kJ/mol),晶体片段结构如图所示。又发现从N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是:
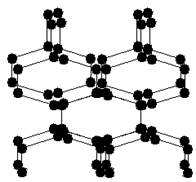
A.该晶体中含有非极性共价键
B.含N5+离子的化合物中既有离子键又有共价键
C.高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D.这种固体的可能潜在应用是烈性炸药或高能材料
参考答案:C
本题解析:A、高聚氮中含N-N键,属于非极性共价键,正确;B、含N5+离子的化合物,为离子化合物,还存在N-N键,则含N5+离子的化合物中既有离子键又有共价键,正确;C、同素异形体的研究对象为单质,而N5+为离子,与单质不能互为同素异形体,错误;D、N-N易断裂,高聚氮不稳定,能量较高,则固体的可能潜在应用是烈性炸药或高能材料,正确。
本题难度:一般