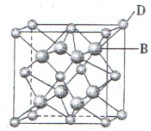
1、填空题 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
(1)E+离子基态时的电子排布式为_______________
(2)A2F的分子空间构型为_____________,FO3分子中F原子的杂化方式 ______________
(3)CA3极易溶于水,其原因主要是______________
(4)从图中可以看出,D 与B形成的离子化合物的化
学式为______________(用元素符号表示),该离子晶体的
密度为ag·cm-3,则晶胞的体积是____________(写出表达式即可,不用化简)
(5)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则 E的晶体中E原子的配位数为?
参考答案:(15分)
(1)1s22s22p63s23p63d10或[Ar]3d10(2分)?(2)? V形? sp2 (各2分)
(3)NH3分子与H2O 分子间形成氢键(2分)?
(4)CaF2(2分)?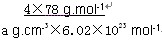 ?(3分)?(5)12(2分)
?(3分)?(5)12(2分)
本题解析:
有A、B、C、D、E、F六种元素,A为氢元素; B为氟元素; C为氮元素; F为硫元素; E为Cu元素,D与B可形成离子化合物,由晶胞结构图1可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为8×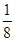 +6×
+6×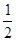 =4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为DF2,D为+2价,D是主族元素,且与副族元素E同周期,故D为Ca元素,
=4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为DF2,D为+2价,D是主族元素,且与副族元素E同周期,故D为Ca元素,
(1)E是Cu元素,是29号元素,原子基态时的电子排布式为[Ar]3d104s1;
(2)A2F分子是H2S,S原子成2个S-H键,含有2对孤对电子对,杂化轨道数目为4,采取sp3杂化;
(3)NH3中N元素的电负性很强,与水分子之间形成氢键,且二者都是极性分子,故氨气极易溶于水,
(4)由晶胞结构图可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为:
8×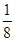 +6×
+6×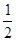 =4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为CaF2,晶胞的质量为
=4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为CaF2,晶胞的质量为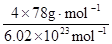 ,晶体的密度为ρ(g?cm-3),则晶胞的体积是
,晶体的密度为ρ(g?cm-3),则晶胞的体积是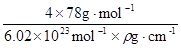 ;
;
(5)Cu单质为面心立方最密堆积,以面心上的Cu为中心可以做三个切面,每个切面上有四个Cu原子,则Cu原子的配位数为12个。
考点定位:本题考查了位置结构性质的相互关系应用;原子核外电子排布;判断简单分子或离子的构型;晶胞的计算;原子轨道杂化方式及杂化类型判断;化学键和等知识,题目综合性较大,难度较大,。
本题难度:一般
2、填空题 A、B、C、D、E五种元素,A元素的周期数、主族数、原子序数相同;B的基态原子核外有3种能量不同的原子轨道,且每种轨道中的电子数相同;C元素的电离能如图所示;D元素的价电子构型为nsnnpn+2;E是第4周期的过渡元素,血红蛋白中的E元素与BD形成的配位键比与D2形成的配位键强。E单质与BD形成的配合物E(BD)5,常温下呈液态,熔点为-20.5℃,沸点为103 ℃,易溶于非极性溶剂。
C元素的电离能

(1)E(BD)5晶体属于________(填晶体类型)。
(2)A元素和B元素组成的化合物分子之间________(填“能”或“不能”)形成氢键。
(3)基态E原子的电子排布式为___________________________________ 。
(4)B、C、D三种元素的电负性由大到小的顺序是________(填元素符号)。
(5)C2和B2A2的分子中根据电子云重叠的方式不同,都包含的共价键类型有________。
(6)已知原子数和电子数相同的微粒叫等电子体,等电子体的结构相似。根据
下表数据,说明BD分子比C2分子活泼的原因_____________________________。
?
| X—Y
| X=Y
| X≡Y
|
BD的键能/kJ·mol-1
| 357.7
| 798.9
| 1 071.9
|
C2的键能/kJ·mol-1
| 154.8
| 418.4
| 941.7
|
?
参考答案:(1)分子晶体
(2)不能
(3)1s22s22p63s23p63d64s2
(4)O、N、C
(5)σ键和π键
(6)CO中断裂第一个π键消耗的能量(273 kJ)比N2中断裂第一个π键消耗的能量(523.3 kJ)小,CO的第一个π键较容易断裂,因此CO较活泼
本题解析:由题中信息可推知A是H、B是C、C是N、D为O、E为Fe。(1)配合物Fe(CO)5常温下呈液态,易溶于非极性溶剂,则Fe(CO)5晶体为分子晶体。(2)C元素的非金属性较弱,故C、H元素形成的化合物中没有氢键。(3)略。(4)C、N、O是同周期的元素,其电负性随着原子序数的增大而增大,故三者电负性由大到小的顺序是:O、N、C。(5)N2与C2H2的分子中都包含的共价键有σ键和π键(在N≡N和C≡C中都包含了一条σ键和两条π键)。(6)CO与N2是等电子体,结构相似,但CO中断裂第一个π键消耗的能量为:1 071.9-798.9=273 kJ;而N2中断裂第一个π键消耗的能量为:941.7-418.4=523.3 kJ,可见CO的第一个π键容易断裂,因此CO比N2活泼。
本题难度:一般
3、选择题 下列说法错误的是
[? ]
A、含有共价键的化合物一定是共价化合物
B、在共价化合物中一定含有共价键
C、含有离子键的化合物一定是离子化合物
D、双原子单质分子中的共价健一定是非极性键
参考答案:A
本题解析:
本题难度:简单
4、填空题 一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键;如果两个成键元素间的电 负性差值小于1.7,它们之间通常形成共价键。请查阅下列化合物中元素的电负性数值,判断它们是离子化合物还是共价化合物。

①NaCl ②AlCl3 ③NO ④MgO ⑤BeCl2 ⑥CO2
共价化合物________;离子化合物_________。
参考答案:②③⑤⑥;①④
本题解析:
本题难度:一般
5、选择题
某些化学试剂可用干净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al2(OH)nClm·yH2O]x,式中m等于
( ? )
A.3-n
B.6-n
C.6+n
D.3+n
参考答案:B
本题解析:
本题难度:简单