1、选择题 A、B、C、D、E?是同一短周期的五种元素,A和B的最高价氧化物对应的水化物呈碱性,且碱性前者强于后者,C和D的气态氢化物的水溶液呈酸性,且酸性前者强于后者,五种元素形成的简单离子中,E的离子半径最小,则它们的原子序数由大到小的顺序是( )
A.BADCE
B.ECDAB
C.BAEDC
D.CDEBA
参考答案:D
本题解析:
本题难度:一般
2、选择题 甲醛分子式为CH2O,有强烈刺激性气味的气体,甲醛在常温下是气态,被世界卫生组织确定为致癌和致畸形物质。下列关于其结构及性质的分析正确的是(?)
A.C原子采取sp3杂化,O原子采取sp杂化
B.甲醛分子中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构
C.甲醛分子与水分子间可以形成氢键,甲醛分子间不能形成氢键
D.甲醛分子为非极性分子
参考答案:C
本题解析:甲醛是平面型结构,碳原子是sp2杂化,属于极性分子,选项ABD都是错误的,C正确,答案选C。
本题难度:简单
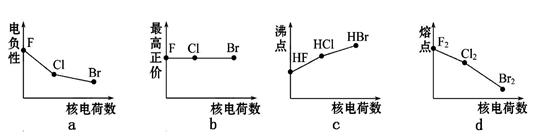
3、填空题 (6分)卤族元素包括F、Cl、Br、I等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 (填写序号)。
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷。
①下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 ,
该功能陶瓷的化学式为 ;

②第一电离能介于B、N之间的第二周期元素有 种。
(3)ZnCl2与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有σ键的物质的量为 。
参考答案:(1)a(1分)(2)①2(1分)BN(1分) ②3(1分) (3)16mol(2分)
本题解析:(1)a.同一主族中,元素的电负性随着原子序数的增大而减小,所以从氟到溴,其电负性逐渐减小,故正确;b.氟元素没有正化合价,第VIIA族氯、溴元素的最高化合价数值等于其族序数,故错误;c.第VIIA族元素氢化物的沸点随着相对分子质量的增大而增大,但HF分子间能形成氢键,氢键属于特殊的分子间作用力,强度大于分子间作用力,沸点最高,故错误;d.由于卤族元素的单质均属于分子晶体,随相对分子质量增大范德华力增大,因而沸点逐渐升高,故错误;故选a;
(2)①B的原子半径比N大,因而结构示意图中大球代表B原子,B原子个数=8×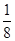 +1=2,N原子个数=1+4×
+1=2,N原子个数=1+4×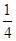 =2,该晶胞中N原子和B原子个数之比=2:2=1:1,所以其化学式为BN。
=2,该晶胞中N原子和B原子个数之比=2:2=1:1,所以其化学式为BN。
②同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素。
(3)在该化合物中N与H之间含有3个σ键,另外N与Zn之间含有配位键,所以1mol该配合物中含有σ键的物质的量为1×4+3×4=16mol。
本题难度:一般
4、简答题 A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同一周期也不在同一主族,D的氢化物和最高价氧化物对应的水化物均为强酸,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.据此回答下列问题:
(1)A和D氢化物中,沸点较低的是______(选填“A”或“D”).
(2)元素C在元素周期表中的位置是______,B的最高价氧化物对应水化物的电子式为______.
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为______,它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为______.
参考答案:根据题设条件可推知A为O,B为Na,C为Al,D为Cl,E为Ca,则
(1)由于H2O分子间存在氢键,其沸点高于HCl,故答案为:D;
(2)Al的原子核外有3个电子层,最外层电子数为3,则位于第三周期ⅢA族,Na的最高价氧化物对应的水化物为NaOH,Na+与OH-以离子键结合,OH-中,O原子与H原子以共价键结合,电子式为
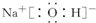
,
故答案为:第三周期ⅢA族;
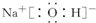
;
(3)钙、氯、氧可形成Ca(ClO)2、Ca(ClO3)2、Ca(ClO4)2,其中满足题设条件下的盐为Ca(ClO)2(次氯酸钙),由于在酸性环境中ClO-具有强氧化性,Cl-具有还原性,二者发生氧化还原反应生成Cl2和H2O,离子反应为ClO-+Cl-+2H+═Cl2↑+H2O,
故答案为:次氯酸钙;ClO-+2H++Cl-═Cl2↑+H2O.
本题解析:
本题难度:一般
5、填空题 下表是元素周期表的一部分,回答下列问题:
| I?A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0
2
①
②
③
3
④
⑤
⑥
⑦
⑧
⑨
⑩
|
(1)写出①、②两种元素的符号______、______
(2)写出⑦、⑩两种元素的名称______、______
(3)在这些元素中,______(用元素符号填写,下同)是最活泼的金属元素;______是最活泼的非金属元素;______是最不活泼的元素.
(4)这些元素的最高价氧化物的对应水化物中______(用化学式填写)酸性最强;______(用化学式填写)碱性最强;能形成两性氢氧化物的元素是______(用元素符号填写)
(5)从③到⑨的元素中,______(用元素符号填写)原子半径最小.
(6)比较④和⑤的化学性质______(用元素符号填写)更活泼,可用______试剂验证.
参考答案:(1)①位于第二周期第ⅡA族,为Be元素,②位于第二周期第ⅥA族,为O元素,故答案为:Be;O;
(2)⑦位于第三周期第ⅣA族,为硅元素,⑩位于第三周期0族,为氩元素,故答案为:硅;氩;
(3)同主族元素从上到下元素的非金属性逐渐减弱,金属性逐渐增强,同周期元素从左到右元素的非金属性逐渐增强,金属性逐渐减弱,则金属性最强的元素位于第三周期第ⅠA族,为Na元素,非金属性最强的元素为于第二周期第ⅦA族,为F元素,最不活泼的元素位于0族,为Ar元素,故答案为:Na;F;Ar;
(4)同主族元素从上到下元素的非金属性逐渐减弱,非金属越强的元素,对应的最高价氧化物对应水化物的酸性越强,因F无正价,所以酸性最强的HClO4,Na的金属性最强,则对应最高价氧化物对应水化物的碱性最强,为NaOH,能形成两性氢氧化物的元素是Al,故答案为:HClO4;NaOH;Al;
(5)根据原子半径的递变规律判断,同一周期,原子半径从左到右逐渐减小,同一主族原子半径从上到下逐渐增大,则原子半径最小的为F,故答案为:F;
(6)金属性越强的元素,对应单质越活泼,与水反应越剧烈,则Na的金属性大于Mg,故答案为:Na;水.
本题解析:
本题难度:一般