1、填空题 (10分)科学家用NaNO3和Na2O在一定条件下化合制得晶体A,A由钠离子和某阴离子B构成, 则:
(1)A的化学式为?,
(2)A对CO2特别敏感,与CO2反应相当剧烈,生成两种常见的物质,该反应的化学方程式为:?;
(3)此外,科学家还制备了另一种钠盐D,其与A的组成元素完全相同,D中的阴离子与A中的阴离子表观形式相同(元素种类和原子个数均相同),但D中阴离子的结构中含有一个过氧键:-O-O- ,电导实验表明,同条件下其电导能力与NaCl相同,该阴离子的化学式为?,其与水反应生成过氧化氢的离子方程式为? ?,该反应?(填是或不是)氧化-还原反应
?,该反应?(填是或不是)氧化-还原反应
2、选择题 在化学上,常用短线表示化学键。在如图所示的结构中,直线不表示化学键或不完全表示化学键的是?
[? ]
A.石墨 ?
?
B.白磷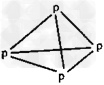 ?
?
C.CCl4?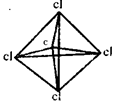 ?
?
D.C8H8(立方烷)
3、填空题 (每空2分?共16分)?20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;Ⅲ、分子中价层电子对之间的斥力主要顺序为:? i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;? ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;? iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;? iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
n+m
| 2
| ?
|
VSEPR理想模型
| ?
| 正四面体
|
价层电子对之间的理想键角
| ?
| 109°28′
|
(2)请用VSEPR模型解释CO2为直线型分子的原因?。
(3) H2O分子的立体构型为:?,请你预测水分子中∠H-O-H的大小范围为?,原因是?。
(4) SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:?。
4、选择题 既有离子键,又有极性键的化合物是( )
A.Na2O2
B.H2S
C.H2O2
D.NaOH
5、选择题 下列含有极性键的非极性分子
①NH3②BF3③N2 ④CO2⑤CH4⑥H2S ⑦SO2⑧CS2 ⑨H2O ⑩HF
?
A.②③④⑤
B.①④⑤⑨
C.②④⑤⑧
D.④⑤⑦⑧