1、填空题
Ⅰ.甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同。
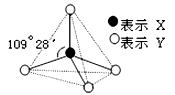
已知:甲、乙晶体类型相同,单质甲能与乙发生置换反应,丙、丁、己三种粒子均含有等量的总电子数,其中丙、己是同一类晶体中的分子,己在常温下呈液态,能产生两种10电子的离子,丁是阳离子且与丙符合“等电子原理”(具有相同电子数和原子数的分子或离子互称为等电子体),戊通常为气体与丙结构相似,但分子中多了24个价电子。
(1)写出液态己产生两种等电子粒子的电离方程式:?。
(2)X、Y原子的最外层都满足8电子的分子是?(填字母代号)
A.甲? B.乙? C.丙? D.戊? E.己
(3)写出甲与乙发生置换反应的反应方程式:?。
(4)丙是目前重要的能源之一。
①丙和己在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是:?。
②现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其正极反应的电极方程式为?。
(5)请写出一种与戊符合“等电子原理”的离子?。
Ⅱ.A 、B 、C 、D 、E 五种短周期元素,原子序数依次增大.A、D同主族,A 与B 、C 分别构成电子数相等的化合物w、k,且w是一种能产生温室效应的气体;D 元素最外层电子数是次外层电子数的3 倍;A 、B 、C 、D 可形成化合物x;A 、D 、E 可形成化合物y;A 、C 、D 可形成化合物z.x、y、z 均为阳离子和阴离子个数比是1 : 1 的离子化合物.回答下列问题:
(1)y的电子式为_________________;w属于______ (填“极性”或“非极性)分子;
(2)与E 同主族且为第七周期的元素原子序数为_________________;
(3)在同主族氢化物的性质递变中,k 的沸点反常,这可以用__________来解释(填字母序号);
A.共价健? B.离子键 C.氢键 D.范德瓦耳斯力
(4)常温下,x 与y以物质的量之比1 : 2 反应后所得溶液显_______(填“酸”、“碱”或“中”)性,由产物分析,原因是________________________(用离子方程式表示);
(5)由k与D 的单质、KOH 溶液构成原电池,负极会产生C 的单质。则其负极反应为______________________________;一段时间后,溶液pH__________(填“增大”、“减小”或“不变” )。
参考答案:Ⅰ. (1)2H2O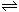 H3O++OH-?(2)D? (3)SiO2+2C
H3O++OH-?(2)D? (3)SiO2+2C Si+2CO↑
Si+2CO↑
(4)① CH4+H2O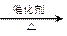 CO+3H2 ?② 2H2O+O2+4e-=4OH-
CO+3H2 ?② 2H2O+O2+4e-=4OH-
(5)SO42-或SiO44 -或PO43-(写出任意一种即可)
Ⅱ. ( 1 ) 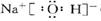 ?非极性? ( 2 ) 87? ( 3 ) C
?非极性? ( 2 ) 87? ( 3 ) C
( 4 )碱? NH?3·H2O 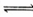 ?NH4+ + OH-? CO32- + H2O
?NH4+ + OH-? CO32- + H2O 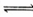 ?HCO3-+ OH-
?HCO3-+ OH-
( 5 ) 2NH3 一 6e-+ 6OH- ="=" N2 + 6H2O?减小
本题解析:略
本题难度:简单
2、填空题 用电子式表示下列化合物的形成过程(1)H2O______;(2)MgCl2______.
参考答案:(1)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为

,
故答案为:

;
(2)MgCl2为离子化合物,用电子式表示的形成过程为

,
故答案为:

.
本题解析:
本题难度:一般
3、选择题 下列物质属于离子化合物的是?
[? ]
A.C60?
B.HCl?
C.C6H6?
D.CaCl2
参考答案:D
本题解析:
本题难度:简单
4、选择题 元素X、Y、Z原子序数之和为36,X、Y在同一周期,X2+与Z2-具有相同的核外电子层结构.下列推测正确的是( )
A.同族元素中Z的氢化物稳定性最高
B.原子半径X>Y,离子半径X2+>Z2-
C.同主族元素中X的金属性最弱
D.同周期元素中Y的最高价含氧酸的酸性最强
参考答案:X2+与Z2-具有相同的核外电子层结构,则X为第ⅡA族元素,Z为第ⅥA族元素,且在周期表中,X在Z元素的下一周期,元素X、Y、Z原子序数之和为36,X、Y在同一周期,则X、Y不可能处于第四周期,第四周期二者原子序数之和最小为19+20=39,则X、Y处于第三周期、Z处于第二周期,故X为Mg、Z为O;又因为X、Y、Z原子序数之和为36,则Y的原子序数=36-8-12=16,故Y为S,
A.Z为O元素,同主族自上而下非金属性减弱,故O元素非金属性最强,故水的稳定性最强,故A正确;
B.Mg2+、O2-电子层结构相同,核电荷数越大离子半径越小,故离子半径Mg2+<O2-,故B错误;
C.同周期自左而右金属性减弱,故第三周期中Na的金属性最强,Mg次之,故C错误;
D.同周期自左而右非金属性增强,非金属性越强最高价含氧酸的酸性越强,故HClO4的酸性最强,故D错误;
故选A.
本题解析:
本题难度:简单
5、选择题 氯化硼(BCl3)的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是(?)
A.氯化硼液态时能导电而固态时不导电
B.氯化硼加到水中使溶液的pH升高
C.氯化硼分子呈正三角形,属非极性分子
D.氯化硼B-Cl之间是sp3形成的σ键
参考答案:C
本题解析:氯化硼的熔沸点低,因此形成的晶体是分子晶体。又因为分子中键与键之间的夹角为120o,所以是平面三角形结构,则属于非极性分子,采用的sp2杂化。水解生成氯化氢和氢氧化硼,溶液显酸性,ABD不正确,则答案选C。
点评:该题是中等难度的试题,试题基础性强,主要是考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的创新思维能力和知识的迁移、类推能力。
本题难度:一般