1、选择题 下列物质性质的变化规律,与共价键的键能大小有关的是
[? ]
A.F2、Cl2、Br2、I2的溶点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减小
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的溶点依次降低
参考答案:BC
本题解析:
本题难度:一般
2、简答题 下列五种物质中,①H2O②CO2③Na2O2④NaOH⑤NaBr,只存在共价键的是______,只存在离子键的是______,既存在离子键又存在共价键的是______,含有极性键的是______,是非极性分子的是______.(填编号).
参考答案:非金属元素的原子间形成共价键,H2O和CO2是非金属元素形成的共价化合物,只存在共价键;一般活泼的金属和活泼的非金属容易形成离子键,NaBr中只有一种化学键离子键;Na2O2和NaOH 是含有离子键的离子化合物,同时还含有共价键;不同非金属原子之间形成极性键,所以H2O 和CO2 含有极性键,NaOH中氧元素和氢元素之间形成极性键;CO2构型为直线形正负电荷的重心重合,电荷分布均匀属于非极性分子,
故答案为:①②;⑤;③④;①②④;CO2.
本题解析:
本题难度:简单
3、选择题 有关化学用语正确的是( )
A.乙烯的结构简式CH2CH2
B.乙醇的结构简式C2H6O
C.四氯化碳的电子式
D.乙酸的分子式C2H4O2
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列说法正确的是(?)?
A. C 、N、O的第一电离能依次增大?
B. NH3、H3O+、NH4+?均含有配位键
C. P4、 CCl4、 CH4 均为正四面体结构,键角均为109°28′
D.HClO?、 HClO3?、?HClO4的酸性依次增强
参考答案:D
本题解析:气态电中性基态原子失去1个电子转化为气态基态正离子所需要的最低能量叫做第一电离能,同周期元素自左向右第一电离能逐渐减小,A不正确。氨气中不存在配位键,B不正确。白磷分子中键角是60°,所以正确的答案是D。
本题难度:简单
5、填空题 【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为?。
(2)熔沸点:NH3?PH3(>、<、=)原因是?
(3)N、P、As三种元素电负性由小到大的顺序为?,NCl3分子中中心原子的杂化方式为?。
(4)汽车尾气中CO和NO 经催化剂作用变成N2和CO
经催化剂作用变成N2和CO 2,此反应中三种元素第一电离能由小到大的顺序为?,在这四种物质中含有极性键的非极分子内
2,此反应中三种元素第一电离能由小到大的顺序为?,在这四种物质中含有极性键的非极分子内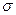 键和
键和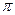 键的比为?。
键的比为?。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有?,配位体为?。
A.氢键
B.离子键
C.共价键
D.配位键[E.范德华力
 对,则[Cu(NH3)n]+中n的值为?
对,则[Cu(NH3)n]+中n的值为? ?。
?。