1、填空题 (8分)【化学-物质结构与性质】
碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序 为 。
为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb 4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为
4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为  ,每个Ba2+与 个O2-配位。
,每个Ba2+与 个O2-配位。
2、选择题 现有四种短周期元素的原子半径及主要化合价数据如下表所示:
| 元素 | 甲 | 乙 | 丙 | 丁
原子半径/nm
0.186
0.102
0.152
0.074
主要化合价
+1
+6、-2
+1
-2
|
下列叙述不正确的是( )
A.甲单质的熔点比丙单质的熔点高
B.甲单质可用电解其熔融盐的方法冶炼而得
C.常温下,丁的两种氢化物均为液体
D.乙的简单离子是四种元素各自形成的简单离子中半径最大的
3、选择题 下列电子式中错误的是
[? ]
A.Mg2+
B.
C.
D.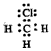
4、选择题 下列电子式书写正确的是( )
A.NH3
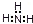
B.CCl4
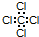
C.N2
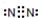
D.CO2
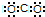
5、填空题 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布?。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C?B(选填“>”“<”),第一电离能N>O,原因是?。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为?,其中硫原子采用?杂化,氧原子的价电子排布图为?,任意写出一种SO42-等电子体?。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。
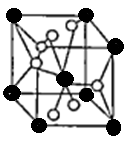
则该氧化物的化学式?(图中钛原子用“O”表示。氧原子用“O”表示)