1、选择题
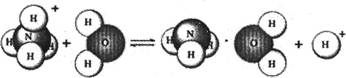
则下列有关NH4 Cl溶液里存在的微粒的叙述,不正确的是
A.存在NH3·H2O,其结构式为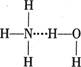
B.存在NH4+,其电子式为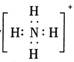
C.存在H3O+,其结构式为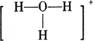
D.存在OH-,其电子式为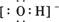
参考答案:A
本题解析:A选项错误原因是在一水合氨分子中,不只是N、H原子间存在氢键,O、H原子间也存在氢键,故错。其余选项均是正确的。
本题难度:一般
2、选择题 把下列溶液加水稀释,溶液中每种离子的浓度都不会增加的是
A.H2SO4溶液
B.Na2SO4溶液
C.Na2CO3溶液
D.FeC13溶液
参考答案:B
本题解析:A、H2SO4溶液加水后OH―增加; B.Na2SO4溶液加水后Na+、SO42―减少,H+、OH―不变;C.Na2CO3溶液加水后H+浓度增加;? D.FeC13溶液加水后水解得更多,H+浓度增加;选B。
本题难度:简单
3、选择题 下列比较中,正确的是(? )
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.物质的量浓度相等的NH4Cl和 NaOH溶液等体积混合后:
c(NH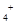 )>c(Cl
)>c(Cl )>c(Na
)>c(Na )>c(OH
)>c(OH )>c(H
)>c(H )
)
C.物质的量浓度相等的H2S和NaHS混合溶液中:
c(Na )+ c(H
)+ c(H )=c(S
)=c(S )+ c(HS
)+ c(HS )+ c(OH
)+ c(OH )
)
D.同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH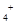 )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
参考答案:D
本题解析:A、同温度同物质的量浓度时,HF比HCN易电离,说明HF的酸性比HCN的酸性强,根据盐的水解规律“越弱越水解”,二者的钠盐的水溶液均呈碱性,但NaCN的水解程度大于NaF的水解程度,所以NaCN溶液的pH值大,错误;B、物质的量浓度相等的NH4Cl和 NaOH溶液等体积混合后生成一水合氨与氯化钠,溶液呈碱性,离子浓度的大小关系是c(Cl )=c(Na
)=c(Na )> c(OH
)> c(OH )> c(NH
)> c(NH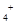 )> c(H
)> c(H ),错误;C、物质的量浓度相等的H2S和NaHS混合溶液,根据电荷守恒规律有c(Na
),错误;C、物质的量浓度相等的H2S和NaHS混合溶液,根据电荷守恒规律有c(Na )+ c(H
)+ c(H )=2c(S
)=2c(S )+ c(HS
)+ c(HS )+ c(OH
)+ c(OH ),错误;D、同物质的量浓度的4种溶液中,①的铵根离子与铝离子水解都使溶液呈酸性,所以铝离子的存在抑制铵根离子的水解,铵根离子浓度最大;②中只发生铵根离子的水解;③中的醋酸根离子水解使溶液呈碱性,所以对铵根离子的水解起促进作用;④中只发生一水合氨的电离,电离程度很小,所以铵根离子浓度最小,因此c(NH
),错误;D、同物质的量浓度的4种溶液中,①的铵根离子与铝离子水解都使溶液呈酸性,所以铝离子的存在抑制铵根离子的水解,铵根离子浓度最大;②中只发生铵根离子的水解;③中的醋酸根离子水解使溶液呈碱性,所以对铵根离子的水解起促进作用;④中只发生一水合氨的电离,电离程度很小,所以铵根离子浓度最小,因此c(NH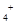 )由大到小的顺序是:①>②>③>④,正确,答案选D。
)由大到小的顺序是:①>②>③>④,正确,答案选D。
本题难度:一般
4、选择题 常温下,一定量的醋酸与氢氧化钠溶液发生中和反应,当溶液中
A.c(CH3COO-)= c(Na+)时,醋酸与氢氧化钠恰好完全中和
B.c(CH3COO-)> c(Na+)> c(H+)> c(OH-)时,不一定是醋酸过量
C.c(Na+)> c(CH3COO-)> c(OH-)> c(H+)时,一定是氢氧化钠过量
D.c(CH3COO-)= c(Na+)时,该溶液一定呈中性
参考答案:D
本题解析:两者恰好中和时,溶液为醋酸钠溶液,由于CH3COO-水解呈碱性,此时c(Na+)> c(CH3COO-)> c(OH-)> c(H+),故排除AC;
B.当c(CH3COO-)> c(Na+)> c(H+)> c(OH-)时,溶液呈酸性,则一定是醋酸过程,否则混合溶液一定呈碱性,排除B
D:溶液中共四种离子,遵循电荷守恒: c(H+)+c(Na+)=c(CH3COO-)+c(OH-),当c(CH3COO-)= c(Na+)时,c(H+)= c(OH-),溶液呈中性
故答案为D
本题难度:一般
5、选择题 下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O HC+H+
HC+H+
C.C+H2O HC+OH-
HC+OH-
D.HS-+H2O S2-+H3O+
S2-+H3O+
参考答案:C
本题解析:A、B、D项显然属于电离过程,C项碳酸根离子结合水电离的氢离子生成碳酸氢根离子,属于水解反应。
本题难度:一般