1、选择题 下列操作和现象与结论均正确的是(?)
选项
| 操作
| 现象
| 结论
|
A
| 向盐酸酸化的Ba(NO3)2溶液中通入SO2
| 有白色沉淀生成
| BaSO3难溶于酸
|
B
| 向等浓度的KCl、KI混合液中滴加AgNO3溶液
| 先出现黄色沉淀
| Ksp(AgCl)>Ksp(AgI)
|
C
| 溴乙烷与NaOH水溶液共热后,加HNO3酸化,滴加AgNO3溶液
| 出现淡黄色沉淀
| 溴乙烷含溴元素
|
D
| 取久置的Na2O2粉末,向其中滴加过量的盐酸
| 产生无色气体
| Na2O2没有变质
|
?
参考答案:BC
本题解析:盐酸酸化的硝酸钡溶液中相当于有硝酸,在通入SO2,SO2容易被硝酸氧化,故生成难溶的BaSO4沉淀,A错误;Ksp(AgCl)>Ksp(AgI),所以在等浓度的KCl、KI混合液中滴加AgNO3溶液时先生成更难溶的淡黄色沉淀AgI,B正确;检验溴乙烷中的溴元素的方法、操作、现象均正确,C正确;久置的过氧化钠容易和空气中的CO2气体反应生成碳酸钠,碳酸钠滴加盐酸也会产生气体(CO2),所以不能通过产生气体就判断过氧化钠没变质,D错误;故选BC。
本题难度:一般
2、选择题 HF、H2O、CH4、SiH4四种气态氢化物按稳定性由弱到强排列正确的是?
[? ]
A.CH4<H2O<HF<SiH4
B.SiH4<HF<CH4<H2O
C.SiH4<CH4<H2O<HF
D.H2O<CH4<HF<SiH4
参考答案:C
本题解析:
本题难度:一般
3、选择题 X、Y、Z三种元素位于周期表中同一周期,其最高价氧化物对应水化物分别为弱酸、强碱、两性氢氧化物,则这三种元素原子序数的大小顺序是( )
A.X>Y>Z
B.Y>X>Z
C.X>Z>Y
D.Y>Z>X
参考答案:X、Y、Z三种元素位于周期表中同一周期,其最高价氧化物对应水化物分别为弱酸、强碱、两性氢氧化物,则Y为活泼金属、Z为较活泼金属(如Al),X为非金属,
同周期从左向右随原子序数的增大金属性减弱,非金属性增强,
则原子序数为X>Z>Y,
故选C.
本题解析:
本题难度:一般
4、选择题 下列事实所列出的相应结论正确的是( )
| 实验事实 | 结论
A
NH3的水溶液可以导电
NH3是电解质
B
滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色
BaCl2溶液有酸性
C
Na2SiO3溶液中通入CO2产生白色沉淀
酸性:H2CO3>H2SiO3
D
常温下白磷可自燃而氮气须在放电时才与氧气反应
非金属性:P>N
|
A.A
B.B
C.C
D.D
参考答案:A.氨气在水中本身不能电离,氨气属于非电解质,故A错误;
B.盐与盐发生复分解反应生成碳酸钡沉淀和氯化钠,不能说明BaCl2溶液有酸性,故B错误;
C.根据强酸制取弱酸的反应原理可知,Na2SiO3溶液中通入CO2产生白色沉淀,则酸性:H2CO3>H2SiO3,故C正确;
D.氮氮三键的键能大,氮气稳定,但非金属性N>P,一般利用氢化物的稳定性来比较非金属性,故D错误;
故选C.
本题解析:
本题难度:简单
5、推断题 已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C 同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核 10电子的分子。请回答下列问题:
(1)写出位于同一主族的元素的名称:__________。
(2)用电子式表示离子化合物A2B的形成过程:______________________。
(3)写出下列物质的电子式:D元素形成的单质_______; E与B形成的化合物____; A、B、E形成的化合物________; D与E形成的共价化合物__________。
参考答案:(1)氧和硫,氢和钠
(2)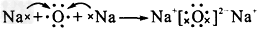 (3)
(3)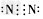 ;
;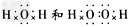 ;
;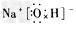 ;
;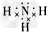
本题解析:
本题难度:一般