1、选择题 19世纪门捷列夫的突出贡献是( )
A.提出了原子学说
B.发现了元素周期律
C.发现了稀有气体
D.提出了分子学说
参考答案:A.道尔顿提出了近代原子学说,故A错误;
B.1869年,俄国化学家门捷列夫发现了元素周期律,故B正确;
C.英国化学家莱姆赛发现了稀有气体,故C错误;
D.阿佛加德罗提出了分子学说,故D错误.
故选B.
本题解析:
本题难度:简单
2、选择题 短周期元素A、B、C、D原子序数依次递增,它们的原子最外层电子数之和为17,A与C在同一主族中,B原子最外层电子数等于A原子次外层电子数,则下列叙述中正确的是
[? ]
A.最高价氧化物对应水化物的酸性:A<C<D
B.A的氢化物的稳定性小于C的氢化物的稳定性
C.原子半径:B>C>D
D.A与D可形成离子化合物
参考答案:C
本题解析:
本题难度:一般
3、选择题 下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
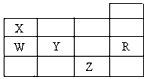
[? ]
A.Y、Z的阴离子电子层结构都与R原子的相同
B.常压下,Y单质的沸点比Z单质的沸点低
C.W的氢化物的稳定性比X的氢化物的稳定性强
D.Y元素的非金属性比W元素的非金属性强
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列说法中,不正确的是( )
A.化学的主要特点是原子、分子水平上认识物质,化学可以识别、改变和创造分子
B.学习化学的基本方法有观察法、实验法、分类法、比较法等
C.化学反应的过程中除了伴随着物质的变化还必然伴随着能量的变化
D.元素的性质随着元素相对原子质量的递增而呈现周期性变化
参考答案:A.物质的构成微粒是分子、原子或离子,化学可以识别、改变和创造分子,但不能创造新的元素,故A正确;
B.化学是一门以实验为基础的科学,化学反应中常常伴随一些特殊现象,所以学习化学的基本方法有观察法、实验法、分类法、比较法等,故B正确;
C.化学反应的实质是旧化学键的断裂和新化学键的形成,断裂化学键需要吸收能量,形成化学键需要放出能量,所以化学反应中不仅有新物质生成,还常常伴随能量的变化,故C正确;
D.原子的核外电子排布中电子层数和最外层电子数都随原子序数的递增而呈现周期性变化,则引起元素的性质的周期性变化,故D错误;
故选D.
本题解析:
本题难度:简单
5、选择题 短周期元素M和N的离子M2+和N2-具有相同电子层结构,则下列说法正确的是?
[? ]
A.M2+的半径比N2-小?
B.M的原子序数比N小?
C.M和N原子的电子层数相等?
D.M和N原子最外层电子数相等
参考答案:A
本题解析:
本题难度:简单