1、实验题 某学校化学兴趣小组想利用元素周期表中第三周期的某些元素探究元素的金属性和非金属性随原子序数变化的规律。该兴趣小组选择的实验仪器和试剂:烧杯、试管、酒精灯、蒸馏水、稀盐酸、酚酞溶液等。
(1)根据上述实验仪器和试剂,该兴趣小组要进行实验探究的元素是____________。
(2)在探究上述元素的单质与水反应时,为了保证实验的安全性,应该在________(填“试管”或“烧杯”)中进行反应,为了切实保证不出危险,还需进行的操作有________________。
(3)在水中滴入1 mL酚酞试剂,但实验时(包括实验后),发现只有钠与水反应的溶液显红色,于是有位 同学得出结论:钠、镁、铝中只有钠能与水反应。你觉得这个结论_________(填“正确”或“不正确”),如果不正确,请你还利用水这种“试剂”来设计实验探究镁与铝的金属性强弱。你的实验设计是__________________。并预测实验现象________________________。
(4)小组中的另外一位同学设计实验用酸来探究这些金属的金属性,但老师删掉了该同学设计的酸与钠反 应的实验,你觉得老师这样做的目的是__________________。该同学在两支试管中各加入2 mL 稀盐酸,然后在其中一支试管中加入2片镁片,另外一支试管中加入2片铝片,反应开始的时候现象是__________________。不过该同学操作时在第二支试管中加入了两块质量较大的铝条,他观察到随着反应的进行,铝与酸的反应越来越快,直至最后反应几乎呈沸腾状态,请你推测铝与盐酸产生这种现象的原因是_________________________。
(5)最后该小组得出实验结论:______________________。
参考答案:(1)钠、镁、铝
(2)烧杯;在烧杯上放一块玻璃片
(3)不正确;在两支试管中分别加入2 mL蒸馏水,再在其中分别滴入2~3滴酚酞试剂,然后在一支试管中加入2片镁片,另外一支试管中加入2片铝片,最后用酒精灯加热,观察试管内溶液颜色的变化;镁片在热水中有气泡产生,水溶液变为浅红色
(4)因为钠与酸反应非常剧烈,防止发生爆炸事故;镁与盐酸反应剧烈,而铝与盐酸能够反应;该反应是放热反应,随着反应的进行,反应液的温度升高,反应速率变快
(5)随着原子序数的递增,钠、镁、铝的金属性逐渐减弱,故同周期元素随着元素序数的递增,元素的金属性逐渐减弱(或非金属性逐渐增强)
本题解析:
本题难度:一般
2、实验题 某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
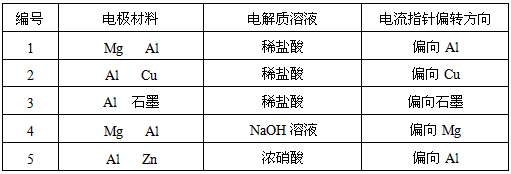
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同?____________。
(2)写出实验3中的电极反应式。
铝为( )_____________________________________;
石墨为( )___________________________________;
(3)实验4中的铝作正极还是负极?写出电池总反应方程式。
________________________________________
(4)解释实验5中电流指针偏向铝的原因。
________________________________________
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受哪些因素的影响?
________________________________________
参考答案:
(1)不同
(2)负极;2Al-6e-==2Al3+;正极;6H++6e-==3H2↑
(3)负极;电池总反应式:2Al+2NaOH+6H2O==2Na[Al(OH)4]+3H2↑
(4)由于铝在浓硝酸中发生钝化,反以锌为负极
(5)与另一种材料的活泼性、电解质溶液的酸碱性以及电解质溶液的氧化性强弱等因素有关
本题解析:
本题难度:困难
3、填空题 (10分)为测定氯化钾和硫酸钾混合物中氯化钾的含量,某同学设计了如下实验:称量样品,溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
回答下列问题:
(1)溶液A溶质的化学式_____,物质C的化学式____。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是____。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是______。
(4)若C的质量为 23.3g,则原混合物中氯化钾的质量分数为______。
23.3g,则原混合物中氯化钾的质量分数为______。
参考答案:BaCl2;BaSO4;25.6g;玻璃棒;32%
本题解析:略
本题难度:一般
4、选择题 下列实验操作安全合理的是
A.加热KMnO4制O2时,为防止试管破裂和胶管腐蚀,试管口略向下倾斜,管口放一团棉花
B.进行SO2性质实验时要在通风橱内进行,多余的SO2一律排到室外
C.白磷有毒,用剩的白磷要用CS2处理后倒入垃圾箱中
D.配制硫酸溶液时,用量筒量取一定体积的浓硫酸慢慢倒入烧杯中的水里,充分搅拌后迅速转移到容量瓶里
参考答案:A
本题解析:SO2污染空气,要进行尾气处理;白磷易自燃,溶于CS2后倒入垃圾箱易引起火灾,另外CS2是易挥发的有毒物质;浓硫酸稀释后要冷却至室温再转入容量瓶。
本题难度:简单
5、简答题 铬是一种银白色的坚硬金属.铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废气是环境中的主要污染源.请回答下面与铬有关的一些问题.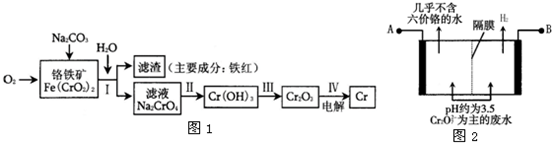
(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:
8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH
该反应中每生成lmol Cr(OH)3时转移电子的物质的量为______mol;
②步骤IV中电解Cr2O3的阳极反应式为______.
(2)某工厂采用电解法处理含铬废水.耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,其原理示意图如图2.阳极区溶液中发生的氧化还原反应为:______.
(3)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作实验室制备纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取重铬酸铵.实验步骤如下:
步骤1:将铬酸钠溶于适量水中,加一定量浓硫酸酸化,使铬酸钠转化为重铬酸钠.
步骤2:先将上述溶液蒸发结晶并趁热过滤,继续将得到的晶体再溶解再蒸发结晶并趁热过滤.然后将得到的滤液冷却至40℃左右进行结晶,用水洗涤,获得重铬酸钠晶体.
步骤3:将得到的重铬酸钠和氯化铵按物质的量之比1:2溶于适量的水,加热至105~110℃时让其充分反应.
①步骤1是一个可逆反应,该反应的离子方程式为:______.
②(NH4)2Cr2O7受热分解制取N2及Cr2O3的化学方程式为:______.
③为了测定实验制得的产品中(NH4)2Cr2O7的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加150mL蒸馏水并加入3mL0.5%淀粉溶液;用0.1000mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL.则该产品中(NH4)2Cr2O7的纯度为.(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-)
参考答案:(1)①Cr元素的化合价由+6价变为+3价,该反应中每生成lmol Cr(OH)3时转移电子的物质的量=1mol×(6-3)=3mol,故答案为:3;
②电解熔融状态的Cr2O3,阳极上氧离子失电子生成氧气,阴极上铬离子得电子发生还原反应,所以阳极上电极反应式为:2O2--4e-=O2↑,故答案为:2O2--4e-=O2↑;
(2)阳极上铁失电子生成亚铁离子进入溶液,Cr2O72-具有强氧化性,能氧化亚铁离子生成铁离子,自身被还原生成铬离子,所以离子反应方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(3)①酸性条件下,CrO42-和氢离子反应生成Cr2O72-,离子方程式为:2CrO42-+2H+?Cr2O72-+H2O,故答案为:2CrO42-+2H+?Cr2O72-+H2O;
②在加热条件下,(NH4)2Cr2O7分解生成N2及Cr2O3,同时还生成水,则该反应方程式为:(NH4)2Cr2O7△.Cr2O3+N2↑+4H2O,
故答案为:(NH4)2Cr2O7△.Cr2O3+N2↑+4H2O;
③根据Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-得关系式Cr2O72-----6S2O32-,
设Cr2O72-的物质的量为x,
Cr2O72-----6S2O32-,
1 6
x 0.1000mol/L×0.03L
1:6=x:(0.1000mol/L×0.03L)
x=0.0005mol,
根据原子守恒得n(Cr2O72-)=n((NH4)2Cr2O7),则m((NH4)2Cr2O7)=0.0005mol×252g/mol=0.126g,
其质量分数=0.126g0.140g×100%=90%,故答案为:90%.
本题解析:
本题难度:一般