1、填空题 亚氯酸钠(NaClO2)是一种重要的消毒剂.已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸.如图是过氧化氢法生产亚氯酸钠的工艺流程图:
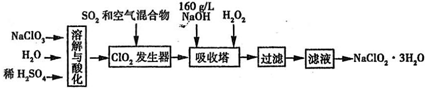
(1)C1O2发生器中所发生反应的离子方程式为______,发生器中鼓入空气的作用可能是______(选填序号).
A.将SO2氧化成SO3增强酸性? B.稀释C1O2以防止爆炸? C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450mLl60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是______g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有______.
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是______.
(4)在吸收塔中,可代替H2O2的试剂是______?(填序号).
A.Na2O2 B.Na2S? C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2?3H2O晶体的实验操作依次是______(填操作名称)
2、实验题 (14分)碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL三口烧瓶中,开启搅拌器。温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤、洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
步骤3中加氨水后的离子方程式?。
(2)测定合成的MgCO3·nH2O中的n值。称量1.000 g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
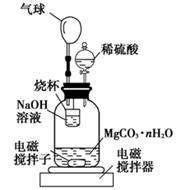
①图中气球的作用是?。
②上述反应后期要升温到30℃,主要目的是?。
③用已知浓度的盐酸滴定烧杯中的溶液时应选用?为指示剂,若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则所测CO2的量会?(填“偏大”“偏小”“无影响”)
④设3次实验测得每1.000 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为a mol,则n值为?(用含a的表达式表示)。
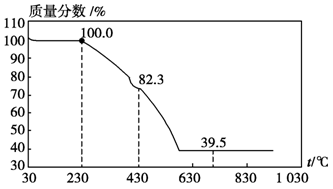
(3)称取100 g上述晶须产品进行热重分析,热重曲线如图。则该条件下合成的晶须中,n=?(选填1、2、3、4、5)。
3、实验题 (8分)某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究。
甲同学设计了如下图所示的实验装置并进行实验:

(1)甲同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因?
?
(2)甲同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是?,由此得出Cl2使有色物质褪色的机理是? ?;
?;
(3)乙同学认为甲设计的实验装置即使改进后还缺少一装置。缺少的装置中发生的离子反应方程式为?
4、简答题 某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
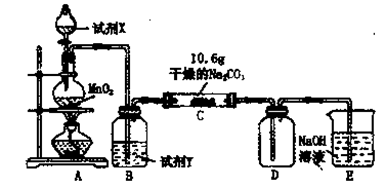 ?
?
(1)A中制取Cl2的离子方程式?.
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和?;
假设2:存在三种成分:NaHCO3和?。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
 ?(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为?。
?(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为?。
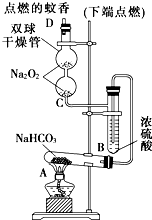
5、简答题 如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片.试回答下列问题:
(1)在A试管内发生反应的化学方程式是______.
(2)B装置的作用是______.
(3)在双球干燥管内发生反应的化学方程式为______.
(4)双球干燥管内观察到的实验现象是______;上述实验现象说明:______.
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是:______.