1、选择题 下列有关金属及其化合物的说法错误的是
A.铁与水蒸气在高温条件下反应生成四氧化三铁和氢气
B.稀硫酸中加入铜粉不反应,再加入硝酸钠仍不反应
C.AlCl3、FeCl2、CuCl2均可通过化合反应制得
D.饱和碳酸钠溶液中通人足量二氧化碳,溶液变浑浊
参考答案:B
本题解析:A、铁与水蒸气在高温条件下反应生成四氧化三铁和氢气,正确;B、稀硫酸中加入铜粉不反应,再加入硝酸钠发生的反应为:3Cu + 2NO3- + 8H+ ="===" 3Cu2+ + 2NO↑+ 4H2O,错误;C、AlCl3、CuCl2均可通过单质与氯气化合制得,FeCl2可通过铁与氯化铁溶液化合制得,正确;D、饱和碳酸钠溶液中通入足量二氧化碳,生成碳酸氢钠,碳酸氢钠的溶解度小于碳酸钠,溶液变浑浊,正确。
本题难度:一般
2、选择题 取两份等量的铝粉,分别与足量的盐酸、氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )
A.1:1
B.1:2
C.1:3
D.3:2
参考答案:由2Al+2NaOH+2H2O═2NaAlO2+3H2↑、2Al+6HCl═2AlCl3+3H2↑可知,
2molAl分别与足量酸、碱反应都生成3molH2,
则两份等量的铝粉分别与足量酸、碱反应生成等量的氢气,
氢气的物质的量之比等于其体积之比,
则相同状态下产生的气体体积之比是1:1,
故选A.
本题解析:
本题难度:简单
3、选择题 为了测定某镁铝合金的成分,取14.7 g合金完全溶于500 mL 3 mol/L的硫酸中,再加入400 mL 8 mol/L的氢氧化钠溶液充分反应,最后只产生一种沉淀。则关于该合金的测定过程的描述正确的是(? )
A.合金中镁的质量分数为63.3%≤Mg%<100%
B.该合金中含有铝的质量至少为5.4 g
C.在产生沉淀后的溶液中一定含有0.2 mol NaAlO2
D.在产生沉淀后的溶液中有1.5 mol Na2SO4
参考答案:AD
本题解析:本体采用极限值法,若硫酸恰好完全反应,氢氧化钠也恰好完全反应,则此时铝的含量为最大值,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为Na2SO4、NaAlO2,根据硫酸根守恒有n(Na2SO4)=n(H2SO4)="0.5L×" 3 mol/L="1.5" mol,根据钠离子守恒有n(NaOH)=2n(Na2SO4)+n(NaAlO2)="0.4L" ×8 mol/L=3.2mol,据此计算n(NaAlO2)=0.2mol,再根据铝原子守恒n(Al)=n(NaAlO2)=0.2mol,m(Al)=5.4g、m(Mg)=9.3g,则Mg占有最低百分数为63.3%,所以选项B、C错误,AD正确。
本题难度:一般
4、选择题 有 MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原溶液中MgCl2、Al2(SO4)3的物质的量浓度之比为
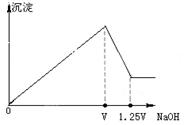
A.1:1
B.2:1
C.3:2
D.2:3
参考答案:A
本题解析:向MgCl2、Al2(SO4)3的混合溶液逐滴加入NaOH溶液,发生反应Mg2++2OH-= Mg(OH)2↓, Al3++3OH-=Al(OH)3↓.所以沉淀逐渐增多。当NaOH过量时有发生反应:Al(OH)3+OH-=AlO2-+2 H2O.沉淀又逐渐减小,当氢氧化铝完全溶解后沉淀达到最小值。由于在沉淀溶解的反应中n(Al(OH)3):n(OH-) =1:1,n(OH-)=0.25V,所以n(Al3+)=n(Al(OH)3)= n(OH-)=0.25V,n(Al2(SO4)3)=1/2n(Al3+)=0.125V.使Al3+产生沉淀消耗的氢氧根离子的物质的量为3n(Al3+)=0.75V,则发生反应Mg2++2OH-= Mg(OH)2↓,消耗的氢氧根离子的物质的量为V-0.75V=0.25V,因此MgCl2的物质的量为1/2n(OH-)=0.125V.所以原溶液中MgCl2、Al2(SO4)3的物质的量之比为0.125V:0.125V=1:1.因此选项为A。2、Al2(SO4)3的混合溶液与NaOH溶液发生反应的情况的知识。
本题难度:一般
5、选择题 工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如图: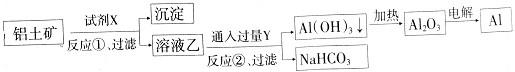
下列叙述不正确的是( )
A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为Fe2O3
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液
参考答案:A.反应①过滤后所得溶液乙为NaAlO2溶液,向NaAlO2溶液中通入过量CO2生成Al(OH)3沉淀,反应的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,故A正确;
B.Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液不反应,则过滤后所得沉淀为Fe2O3,故B正确;
C.电解熔融Al2O3属于氧化还原反应,故C错误;
D.试剂X可能是氢氧化钠等强碱溶液,可与氧化铝反应,故D正确.
故选C.
本题解析:
本题难度:简单