1、实验题 (1)向KAl(SO4)2溶液中滴加过量氨水,现象是____________________________,反应的离子方程式______________________________________________,再向其中加入过量NaOH溶液,反应现象是____________________________________________,反应的离子方程式为_______________________________________________。
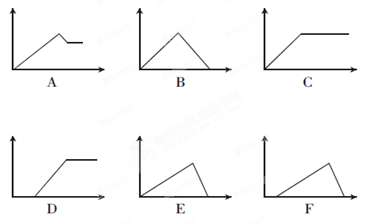
(2)下列六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,请把下表中各反应的相应图象的序号填入表中。
溶液
| 加入的物质
| 答案序号
|
①饱和石灰水
| 通过量CO2
| ?
|
②AlCl3溶液
| 通过量NH3
| ?
|
③MgCl2、AlCl3混合溶 液 液
| 逐滴加NaOH溶液至过量
| ?
|
④AlCl3溶液
| 逐滴加NaOH溶液至过量
| ?
|
⑤含少量HCl的AlCl3溶液
| 逐滴加NaOH溶液至过量
| ?
参考答案:(1) (1)生成白色胶状沉淀;Al3++3NH 3·H2O===Al(OH)3↓+3NH;白色胶状沉淀溶解,溶液变澄清;Al(OH)3+OH-===AlO+2H2O 3·H2O===Al(OH)3↓+3NH;白色胶状沉淀溶解,溶液变澄清;Al(OH)3+OH-===AlO+2H2O
(2)B;C;A;E;F(各1分)
本题解析:略
本题难度:一般
2、选择题 下列反应的离子方程式不正确的是(? )
A.铝粉与烧碱溶液反应:
2Al+2OH-+2H2O====2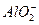 +3H2↑ +3H2↑
B.铜与氯化铁溶液反应:
Cu+Fe3+====Fe2++Cu2+
C.AlCl3溶液中加过量氨水:
Al3++3NH3·H2O====Al(OH)3↓+3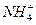
D.MgCl2溶液中加过量烧碱:
|
Mg2++2OH-====Mg(OH)2↓
参考答案:B
本题解析:B项中离子方程式电荷不守恒。
本题难度:一般
3、填空题 (6分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
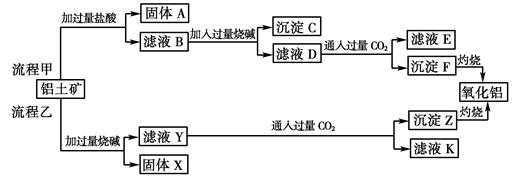
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为?。
(2)流程乙加入烧碱后生成SiO32—的离子方程式为?。
(3)验证滤液B含Fe3+,可取少量滤液并加入?(填试剂名称)。
(4)滤液E、K中溶质的主要成份是?(填化学式),写出该溶液的一种用途
?。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=?。
参考答案:(6分,每空1分):(1)Al2O3+6H+===2Al3++3H2O?
(2)SiO2+2OH-===SiO32—+H2O? (3)硫氰化钾(或硫氰酸、苯酚溶液等合理答案)
(4)NaHCO3 制纯碱或做发酵粉等合理答案? (5)5.6×10-10 mol/L
本题解析:(1)氧化铝是两性氧化物,和盐酸反应的方程式是Al2O3+6H+===2Al3++3H2O。
(2)二氧化硅是酸性氧化物,和氢氧化钠溶液反应的方程式是SiO2+2OH-===SiO+H2O。
(3)检验铁离子的试剂是KSCN溶液或者是苯酚。
(4)由于CO2都是过量的,所以溶液中的溶质主要都是碳酸氢钠,其主要用途是制纯碱或做发酵粉等。
(5)pH=13,所以溶液中的OH-浓度是0.1mol/L,因此根据氢氧化镁的溶度积常数可知,此温度下残留在溶液中的c(Mg2+)=5.6×10-12÷0.12=5.6×10-10 mol/L。
本题难度:一般
4、填空题 镁化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的______________,还生成少量的______________(填化学式);
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是_____________,该化合物水解的化学方程式为_________________;
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。

下列选项中正确的是_______________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g) △H=+600kJ·mol-1
参考答案:(1)MgO;Mg3N2
(2)+2;
(3)①②③⑤
本题解析:
本题难度:一般
5、选择题 1989年世界卫生组织把铝定为食品污染源之一而加以控制使用。铝在以下应用中而加以控制的是?①制铝合金?②制电线?③制炊具?④明矾净水?⑤用明矾 与小苏打制膨松剂?⑥用氢氧化铝凝胶制胃舒平药片?⑦银色漆颜料?⑧易拉罐?⑨包装食品 与小苏打制膨松剂?⑥用氢氧化铝凝胶制胃舒平药片?⑦银色漆颜料?⑧易拉罐?⑨包装食品
A.③⑤⑧⑨
B.⑥⑧⑨
C.③⑤⑨
D.③④⑤⑥⑧⑨
参考答案:D
本题解析:略
本题难度:一般
|