1、选择题 两只烧杯中各加入相同体积的3 mol·L-1的稀硫酸置于天平左右两个托盘上,天平平衡,向一个烧杯中加入10.8 g Al,向另一烧杯中加入10.8 g Fe,反应完毕后,下列叙述正确的是(? )
A.若天平倾斜,有可能放Al的一端托盘上升
B.若天平倾斜,一定是放Al的一端托盘上升
C.若天平倾斜,有可能是放Fe的一端上升
D.有可能天平两端仍保持平衡
参考答案:
AD
本题解析:
分两种情况讨论,当H2SO4过量,Al生成的H2多,选A。当H2SO4不足时金属都过量,生成H2相等,选D。
本题难度:一般
2、填空题 (10分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成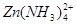 。
。
回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式
___________________________________________________?。
(2)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是?。
①硫酸铝和氢氧化钠?②硫酸铝和氨水
③硫酸锌和氢氧化钠?④硫酸锌和氨水
(3)写出可溶性铝盐与氨水反应的离子方程式
______________________________________________________?。
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
__________________________________________? ________________。
参考答案:(1)Zn+2NaOH===Na2ZnO2+H2↑?(2分)
(2)①③④?(2分)
(3)Al3++3NH3·H2O=== Al(OH)3 ↓+3NH4+?(2分)
(4)可溶性锌盐与氨水反应产生的Zn(OH)2?可溶于过量氨水中,生成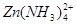 ,氨水的用量不易控制。(4分)
,氨水的用量不易控制。(4分)
本题解析:(1)Zn+2NaOH===Na2ZnO2+H2↑
(2)①③④相似,将硫酸盐滴加于碱液中,一开始没有沉淀生成,继续滴加有沉淀出现,反之,将碱液滴加到硫酸盐溶液中,一开始就有白色沉淀生成,随后沉淀溶解
②互相滴加,现象相同,均产生白色沉淀
故选择①③④
(3)Al(OH)3 不能溶于弱碱:Al3++3NH3·H2O=== Al(OH)3 ↓+3NH4+
(4)可溶性锌盐与氨水反应产生的Zn(OH)2?可溶于过量氨水中,氨水的用量不易控制
本题难度:一般
3、填空题 将一定质量的Al、Fe混合物加入到足量的盐酸中,充分反应后得到标准状况下的氢气8.96L;如果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气6.72L.
(1)写出与碱反应涉及的化学方程式:______;
(2)混合物中Al和Fe的质量分别为______和______;
(3)当混合物与盐酸反应时,转移电子数为______mol;与NaOH溶液反应时转移电子数为______mol.
参考答案:(1)因铝具有两性,可以与酸、碱发生反应,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
? (2)因铝与碱发生反应,而铁与碱不发生反应,由氢气的体积求出铝的质量,
? 2Al+2NaOH+2H2O=2NaAlO2 +3H2↑
?0.02mol? 0.03mol?
?所以铝的质量为0.02mol×27g/mol=5.4g
?同样质量的铝与酸反应?
? 2Al+6HCl=2AlCl3+3H2↑?
? ?0.02mol? 0.03mol?
?铝与酸反应产生的氢气的体积为?0.03mol×22.4L/mol=6.72L,所以Fe与盐酸反应得的氢气的体积为8.96L-6.72L=2.24L,物质的量为0.1mol,
? Fe+2HCl═FeCl2+H2↑
?0.1mol?0.1mol
? 所以铁的质量为0.1mol×56g/mol=5.6g,
? 故答案为:5.4g;5.6g.
?(3)因铝与足量的氢氧化钠溶液反应生成偏铝酸钠
? ?0+3
? Al~AlO2-化合价升高3,失去3e-,0.2molAl 失去电子数应为0.6mol;?
? 同样,0.1molAl 失去电子数应为0.2mol,
? 故答案为:0.8; 0.6.
本题解析:
本题难度:简单
4、选择题 两份铝屑,第一份与盐酸反应,第二份与NaOH溶液反应,产生的氢气的体积比为1︰2,两份铝屑中参加反应的铝的质量比为( )
A.1︰1
B.1︰2
C.1︰3
D.2︰1
参考答案:B
本题解析:略
本题难度:一般
5、填空题 (8分)实验室中有甲、乙、丙三位学生做制备氢氧化铝实验,桌上放着同样的药品:231g浓度为70%的硫酸,含杂质苛性钾20%的烧碱140g及足量的铝屑,三位学生分别制得氢氧化铝w1g,w2g,w3g,实验的三种方案示意图如下:
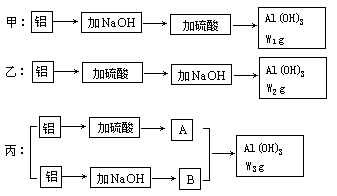
(1)从充分利用原料,降低成本和提高产率等因素分析,哪个学生实验方案最佳(用甲、乙、丙序号表示)__? _____。
(2)三位学生分别制得氢氧化铝质量大小的顺序为(用w1,w2,w3序号表示):___? ____。
参考答案:(1)丙 (2)W3>W1>W2
本题解析:略
本题难度:一般