| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《电解池原理》试题预测(2020年最新版)(十)
参考答案: 本题解析: 本题难度:一般 4、选择题 如图中a、b是惰性电极,通电2min后b电极附近溶液呈红色,b电极生成标准状况时的气体体积为0.224L,NaCl溶液体积为500mL,下列说法不正?确?的是( ) |
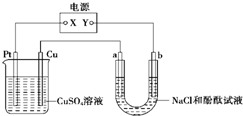
参考答案:通电2min后b电极附近溶液呈红色,则b电极H+放电,则Y为负极,X为正极,Pt为阳极,电解CuSO4溶液发生2CuSO4+2H2O?电解?.?2Cu+O2↑+2H2SO4,电解NaCl溶液发生2NaCl+2H2O?电解?.?2NaOH+Cl2↑+H2↑,
A.由上述分析可知电解过程中CuSO4溶液物质的量浓度变小,故A错误;
B.Y为负极,X为正极,则子流动的方向是由a流向Cu电极,故B正确;
C.氢气为0.224L,n=0.01mol,由H2↑~2e-可知,转移电子为0.02mol,故C正确;
D.NaCl溶液体积为500mL,由H2↑~2OH-可知,电解速率v(OH-)=0.02mol0.5L2min=0.02mol/(L.min),故D正确;
故选A.
本题解析:
本题难度:一般
5、选择题 下列对有关实验的描述不正确的是( )
A.在浓氨水中加入生石灰可以制取少量的NH3
B.用惰性电极电解熔融NaCl:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.氯水和活性炭使红墨水褪色,能用同一原理解释
D.浓硫酸和浓盐酸长期暴露在空气中浓度都会降低
参考答案:BC
本题解析:A.生石灰可与水反应,并放出热量,氨气易挥发,可用于制备氨气,故A正确;B.电解熔融NaCl,生成钠和氯气,如电解氯化钠溶液,则生成氯气、氢气和氢氧化钠,故B错误;C.氯水具有强氧化性,而活性炭起到吸附作用,二者的原理不同,故C错误;D.浓硫酸具有吸水性,而盐酸易挥发,长期暴露在空气中浓度都会降低,故D正确,故选BC。
考点:考查氨气、氯气、电解以及浓硫酸的性质
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《盖斯定律》.. | |