|
高中化学知识点大全《电解池原理》试题预测(2020年最新版)(六)
2021-06-11 05:43:56
【 大 中 小】
|
1、选择题 (1)某小组为研究电化学原理,设计如图装置,下列叙述正确的是?。
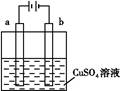
A.若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-=Cu
B.若a和b为石墨,通电后滴入酚酞,a电极附近溶液呈红色
C.若a为铜,b为铁,通电后Cu2+向a电极移动
D.若a为粗铜,b为纯铜,通电后b电极质量增加
| (2)电镀时,镀件与电源的?极连接。化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
①若用铜盐进行化学镀铜,应选用?(填“氧化剂”或“还原剂”)与之反应。
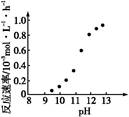
②某化学镀铜的反应速率随镀液pH变化如图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法:?。
参考答案:(1)D
(2)负 ①还原剂 ②调节溶液pH小于9
本题解析:(1)a、b为石墨,电解CuSO4溶液,a电极是阳极,电极反应:4OH--4e-=2H2O+O2↑,A选项错;由于a电极上OH-放电,造成H+浓度增大,溶液呈酸性,滴入酚酞,溶液不变色,B选项错;若a为铜,则a电极铜失电子而溶解,Cu-2e-=Cu2+,b电极上Cu2++2e-=Cu,所以Cu2+向b极移动,C选项错;a为粗铜,逐渐溶解,b为纯铜,有铜析出而质量增加,D选项正确。
(2)电镀时,镀件与电源的负极相连,溶液中的镀层金属离子得到电子在镀件上析出。
①化学镀的原理就是利用置换反应将镀层金属离子从溶液中置换出来,从铜盐中置换出铜通常选用Fe等还原剂。
②由图可看出溶液pH低于9时,该化学镀的反应速率为0,因此可调节pH略小于9即可使反应停止。
本题难度:一般
2、选择题 用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA为阿伏加德罗常数的值,下列叙述中不正确的是
A.电路中通过电子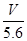 NA NA
B.n = 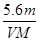
C.溶液中H+增加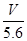 NA NA
D.n = 
参考答案:B
本题解析:阳极:4OH--4e-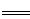 2H2O+O2↑ 2H2O+O2↑
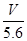 ?mol? ?mol?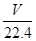 mol mol
阴极:Rn+?+?ne-? ?R ?R
n mol?M
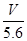 ?mol?m g?n = ?mol?m g?n =  ? ?
电解时,电池反应方程式为:
4R(NO3)n+2nH2O 4R+nO2↑+4nHNO3 4R+nO2↑+4nHNO3
e- ?~? H+
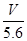 ?mol? ?mol?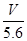 ?mol ?mol
所以B不正确。
本题难度:一般
3、选择题 下列有关用惰性电极电解AgNO3溶液一段时间后的说法错误的是( )
A.电解过程中阴极质量不断增加
B.电解过程中溶液的pH不断降低
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况
D.电解后两极产生的气体体积比为2:1
参考答案:A.电解过程中阴极银离子放电,生成单质Ag,则阴极质量增加,故A正确;
B.由4AgNO3+2H2O?电解?.?4Ag+O2↑+4HNO3,生成硝酸,溶液的酸性增强,pH不断降低,故B正确;
C.由电解反应可知,从溶液中析出单质Ag和氧气,则可向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况,故C正确;
D.电解时只有阳极生成氧气,故D错误;
故选D.
本题解析:
本题难度:一般
4、填空题 熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO )为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO )为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO -52e-===34CO2+10H2O。 -52e-===34CO2+10H2O。
试回答下列问题:
(1)该燃料电池的化学反应方程式为______________________________________________;
(2)正极电极反应式为____________________________________________。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是________,它来自____________。
(4)某学生想用该燃料电池和如图所示装置来电解饱和食盐水:
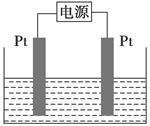
①写出反应的离子方程式_______________________________________。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为_______________________________________________________________。
③若电解后得到200 mL 3.25 mol·L-1 NaOH溶液,则消耗C4H10的体积在标准状况下为________mL。
参考答案:(1)2C4H10+13O2===8CO2+10H2O
(2)13O2+26CO2+52e-===26CO
(3)CO2 负极产物
(4)①2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH-
②5Cl2+I2+6H2O===10HCl+2HIO3 ③560
本题解析:(1)该燃料电池的反应实质是丁烷与氧气反应生成二氧化碳、水,所以总反应的化学方程式为2C4H10+13O2===8CO2+10H2O
(2)用总反应方程式减去负极反应方程式可得正极反应方程式为13O2+26CO2+52e-===26CO
(3)该反应的中有水生成,所以在空气中应充入二氧化碳,以保证碳酸钾电解质的稳定性;二氧化碳来自于电池的负极;
(4)①电解饱和食盐水得到氯气、氢气、氢氧化钠,反应的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH-
②氯气将生成的I2氧化,得到两种酸,反应的Cl2和I2的物质的量之比为5∶1,说明1个Cl原子得电子的数目是1个I原子失去电子数目的1/5,所以Cl的化合价由0价降为-1价,则I的化合价由0价升高为+5价,结合溶液中的水判断该两种酸是HCl和H HIO3,化学方程式为5Cl2+I2+6H2O===10HCl+2HIO3
③电解后得到200 mL 3.25 mol·L-1 NaOH溶液,氢氧化钠的物质的量 是0.65mol,转移电子的物质的量是0.65mol,根据2C4H10+26CO -52e-===34CO2+10H2O,得需要丁烷的物质的量是0.025mol,标准状况下的体积是0.025mol×22.4L/mol=0.56L=560mL。 -52e-===34CO2+10H2O,得需要丁烷的物质的量是0.025mol,标准状况下的体积是0.025mol×22.4L/mol=0.56L=560mL。
考点:考查电化学反应原理的应用与计算
本题难度:困难
5、选择题 如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,装置(丁)中Y极附近红褐色变深,则以下说法正确的是

A.电源B端是正极
B.(甲)装置的C、D电极均有单质生成,且其物质的量之比为2:1
C.欲用(丙)装置给铜镀银,H应该是银,电镀液是硝酸银溶液
D.若向(乙)中滴入酚酞溶液,在F极附近先出现红色
参考答案:D
本题解析:略
本题难度:简单
|
