1、计算题 (6分)某2 .0 L硫酸溶液中含有1.0 mol H2SO4。试计算:
(1)溶液中H2SO4的物质的量浓度;
(2)向上述溶液中加入足量的铁粉,产生气体的体积(标准状况);
(3)假设反应前后溶液体积不变,则所得溶液中Fe2+的物质的量浓度。
参考答案:(6分)解:(1)c(H2SO4) =1.0 mol/2.0 L =" 0.5mol" / L ………………………2分
(2)Fe? +? H2SO4?= FeSO4 +? H2↑…………………1分
1mol? 22.4 L
1.0 mol?V(H2)
V(H2) =" 22.4" L …………………………………………………………1分
(3)n(Fe2+) = n(SO42-) =" 1.0" mol ……………………………………1分
c(Fe2+) =" 1.0" mol /2.0 L =" 0.5" mol / L………………………………1分
本题解析:略
本题难度:一般
2、计算题 (8分)标准状况下11.2 L HCl溶于水形成500 mL 溶液。
(1)所得盐酸的物质的量浓度为?;
(2)向其中加入??g NaOH才能中和完全;
(3)若不考虑加入NaOH对体积造成的影响,所得NaCl的物质的量浓度为?;
(4)再向其中加入??mL 密度为1.7 g/cm3,质量分数为25%的AgNO3溶液可使Cl-完全沉淀。
参考答案:(1)1 mol/L (2)20 (3)1 mol/L (4)200
本题解析:(1)c(HCl)= ?1 mol/L
?1 mol/L
(2)HCl+NaOH=NaCl+H2O,所需NaOH为:0.5×40=20g
(3)c(HCl)=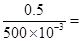 ?1 mol/L
?1 mol/L
(4)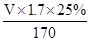 =0.5可知V="200" ml
=0.5可知V="200" ml
本题难度:一般
3、选择题 下列各物质所含原子个数,按照由多到少顺序排列的是( )
①标况下22.4L氦气?②4℃时,9ml水?③0.2mol磷酸?④0.5mol氨气.
A.①④③②
B.④③②①
C.②③④①
D.①④②③
参考答案:B
本题解析:
本题难度:简单
4、简答题 把5.85g?NaCl配成100mL溶液,求其物质的量浓度.该溶液能与多少升0.100mol?L-1AgNO3溶液完全反应?
参考答案:NaCl的物质的量为5.85g58.5g/mol=0.1mol,
NaCl溶液的物质的量浓度为0.1mol0.1L=1mol?L-1,
设该溶液能与x升0.100mol?L-1AgNO3溶液完全反应,则
NaCl+AgNO3═NaNO3+AgCl↓
?1? 1
0.1mol x×0.100mol/L
11=0.1molx×0.100mol/L,解得x=1L,
答:NaCl溶液的物质的量浓度为1mol?L-1,该溶液能与1L0.100mol?L-1AgNO3溶液完全反应.
本题解析:
本题难度:一般
5、计算题 19.2g Cu与过量的50 mL 18 mol·L-1浓硫酸加热完全反应后,
反应方程式如下: Cu + 2H2SO4(浓)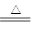 CuSO4?+ SO2↑+ 2H2O 。
CuSO4?+ SO2↑+ 2H2O 。
(1)得到SO2气体的体积(标准状况下)是?L;
(2)若反应后溶液中加入水至溶液的体积为500mL,取出50mL,那么50mL溶液中CuSO4?的物质的量浓度为?mol·L-1;
(3)往反应后溶液中加入足量的BaCl2,可以生成硫酸钡沉淀为?g。
参考答案:(1)6. 72?(2) 0.6 ?(3) 139.8
本题解析:19.2gCu为0.3mol,与足量浓硫酸生成0.3molSO2;同时生成0.3molCuSO4,将溶液稀释至500mL,物质的量浓度为0.6mol/L;反应后溶液中SO42-物质的量为(0.05×18-0.3)mol=0.6mol,向反应后的溶液中加入足量氯化钡溶液生成硫酸钡0.6mol。
点评:本题(3)应用元素守恒的思想。反应前硫总物质的量为0.9mol,生成SO2中S为0.3mol,所以残留溶液中SO42-为0.6mol。
本题难度:一般