1、选择题 下列措施中不能起到节能降耗和保护环境目的的是
A.加大太阳能、水能、风能、地热能等能源开发力度,减少化石燃料的使用
B.研制乙醇汽油技术,降低机动车辆尾气中有害气体排放
C.生产、生活中,努力实现资源的循环利用
D.利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求
参考答案:D
本题解析:石油、煤、天然气的含量是有限的,应该合理开采,选项D不正确,其余选项都是正确的,答案选D。
点评:化学与可持续发展及环境保护尽管不是教学的重点,但该内容与我们的生产、生活息息相关,因此成为历年高考的必考的热点。试题的命题形式是常把化学知识与实际生产、生活、环境保护及科技前沿等问题结合起来,突出化学与可持续发展、环境保护的密切联系,综合考查学生分析问题、解决问题的能力。
本题难度:简单
2、填空题 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。工业上常采用NaClO氧化法生产,其生产工艺如下:
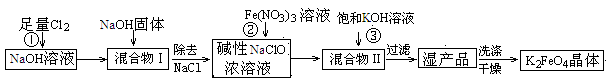
主要反应为:3NaClO+2Fe(NO3)3+10NaOH = 2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH。
(1)写出反应①的离子方程式:?。
(2)从“混合物II”中分离出K2FeO4后,会有副产品,它们都是重要的化工产品,其中一种在工业上用作氯碱工业原料的物质是?。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
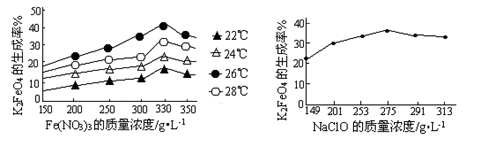
图Ⅰ?图Ⅱ
根据上图分析:工业生产中最佳温度为?℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为?。
参考答案:(1)Cl2+2OH- =Cl-+ClO-+H2O?(2)NaCl?(3)① 26?1.2
本题解析:(1)氯气是酸性气体,能和烧碱溶液反应,反应的离子方程式为Cl2+2OH- =Cl-+ClO-+H2O。
(2)根据流程确定混合物Ⅰ的组成为氯化钠、次氯酸钠以及氢氧化钠的混合物,经过反应②之后所得混合物II的组成有NaNO3、NaCl、NaOH、K2FeO4,从中分离出K2FeO4后,得到的副产品是NaNO3、NaCl、NaOH,其中NaNO3作炸药,NaCl用作调味品或氯碱工业原料等。
(3)寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面,所以根据图像可知工业生产中最佳温度为26℃,因为在该温度下生成高铁酸钾的产率最大,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为=1.2。
本题难度:困难
3、选择题 镁橄榄石(2MgO?SiO2)中阴离子是( )
A.SiO44-
B.SiO64-
C.SiO32-
D.SiO54-
参考答案:A
本题解析:
本题难度:一般
4、选择题 在熔融状态下,Na与KCl存在可逆反应:Na+KCl NaCl+K,通过调整温度,可利用金属Na来制取K。
NaCl+K,通过调整温度,可利用金属Na来制取K。
物质
| K
| Na
| KCl
| NaCl
|
熔点(℃)
| 63.6
| 97.8
| 770
| 801
|
沸点(℃)
| 774
| 883
| 1 500
| 1 413
|
?
根据上表的熔点和沸点,确定由Na与KCl反应制取K的合适温度为(?)
A.770℃?B.801℃
C.850℃?D.770℃~801℃
参考答案:C
本题解析:K、Na的活泼性相近,要从上述可逆的置换反应中制取K,主要是利用K的沸点比Na的低而控制温度使K气化。其余三种物质均为液体,便于生成的K蒸气不断逸出,使反应向生成K的方向进行而制得K。应在801℃~883℃间合理。
本题难度:一般
5、填空题 工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:
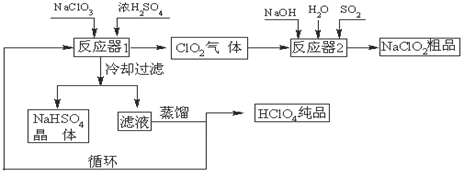
(1)冷却过滤的目的是降低NaHSO4的?,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为?,SO2的
作用是作?剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为?。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较?(填“高”或“低”),容易从溶液中逸出,循环使用的物质是?。
参考答案:(1)溶解度?(2)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;?还原
(3)1:2?(4)低? H2SO4
本题解析:(1)在反应器1中,硫酸钠和硫酸反应获得的硫酸氢钠的溶解度随着温度的降低而减小,这样冷却过滤,可以降低NaHSO4的溶解度并分离出NaHSO4晶体。
(2)在反应器2中,可以实现二氧化氯向NaClO2的转化,二氧化硫可以作为还原剂把ClO2还原为NaClO2,反应的离子方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O。
(3)根据方程式3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O可知,NaClO3既是氧化剂,也是还原剂,其中氯元素的化合价从+5价部分升高到+7价,部分降低到+4价,所以高氯酸是氧化产物,二氧化氯是还原产物。根据电子得失守恒可知,氧化产物与还原产物的物质的量之比为1:2。
(4)可以通过蒸馏滤液的方法得到高氯酸,这说明高氯酸的沸点比较低(沸点:90oC);根据循环图可以发现硫酸作为反应物进入反应器1中,又作为生成物在反应器2中生成,可以循环使用。
本题难度:一般