1、填空题 氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl
参考答案:
本题解析:
本题难度:一般
2、选择题 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是(? )

A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中c(FeBr2)=6 mol·L-1
C.当通入Cl22 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3
参考答案:B
本题解析:离子还原性顺序:I->Fe2+>Br-,由图可知,当Cl2通入1 mol时,与I-反应,1~3 mol时,Cl2与Fe2+反应,3~6 mol时,Cl2与Br-反应,由2Br-+Cl2=Br2+2Cl-知n(Br-)=6 mol,因不知溶液体积,故不能确定溶液中FeBr2的浓度。
本题难度:一般
3、选择题 向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是 :

参考答案:C
本题解析:S2—、Fe2+、Br—、I—的还原性的大小关系是S2—> I—>Fe2+>Br—,根据离子的还原性的顺序,氯气逐一与之反应。A、硫离子与氯气发生置换反应,所以0.1mol硫离子需要0.1mol氯气,标准状况下的体积是2.24L,错误;B、0.1mol亚铁离子被氧化,失去0.1mol电子,需要0.05mol氯气,标准状况下的体积是1.12L,但氧化亚铁离子时先氧化硫离子和碘离子,0.1mol碘离子需要0.05mol氯气,标准状况下的体积是1.12L,所以通入3.36L氯气时,亚铁离子的物质的量开始减少,错误;C、根据以上分析,将硫离子、碘离子、亚铁离子全部氧化时需要氯气的体积是2.24+1.12+1.12=4.48L,0.1mol溴离子被氧化需要0.05mol 氯气,标准状况下的体积是1.12L,所以通入氯气4.48L时溴离子的物质的量开始减少,到5.6L时,变为0,正确;D、通入2.24L氯气时,碘离子开始被氧化,错误,答案选C。
考点:考查S2—、Fe2+、Br—、I—的还原性等效关系的应用,对图像的分析
本题难度:一般
4、选择题 下列物质与HNO3反应时,硝酸既表现出强氧化性又表现出酸性的是:
A.Fe2O3
B.FeS
C.Cu(OH)2
D.C
参考答案:B
本题解析:略
本题难度:简单
5、实验题 (10分)为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
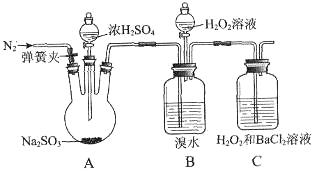
参考答案:
本题解析:
本题难度:困难