1、填空题 (10分)工业上用CO生产燃料甲醇,一定条件下发生反应: CO(g)+2H2(g)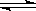 CH3OH(g)。
CH3OH(g)。
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=?。
(2)图2表示该反应进行过程中能量的变化。曲线?(填“a”或“b”)表示不使用催化剂时反应的能量变化,不使用催化剂时该反应的逆反应的活化能为?。
(3)该反应平衡常数K的表达式为?,温度升高,平衡常数K?(填“增 大”、“不变”或“减小”)
大”、“不变”或“减小”)
(4)恒容条件下,下列措施中能使 增大的有?。
增大的有?。
A.升高温度
B.充入He气
C.再充入1molCO和2molH2
D.使用催化剂
2、选择题 某温度下反应N2O4(g) 2NO2 (g);ΔH>0,在密闭容器中达平衡,下列说法正确的是(?)
2NO2 (g);ΔH>0,在密闭容器中达平衡,下列说法正确的是(?)
A.保持体积不变,加入少许N2O4,平衡向逆反应方向移动
B.升高温度v正、v逆都增大,v正增大的倍数小于v逆增大的倍数
C.保持体积不变,升高温度,再达平衡时混和气体颜色变深
D.达到平衡后,降低温度或减小压强平衡移动的方向一致
3、选择题 已知298 K,101 kPa时,2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
A.Q2<Q1<197 kJ·mol-1
B.Q2=Q1=197 kJ·mol-1
C.Q1<Q2<197 kJ·mol-1
D.Q2=Q1<197 kJ·mol-1
4、选择题 光气(COCl2)的分解反应为:COCl2(g) Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
Cl2(g)+CO(g);△H=+108kJ·mol-1。反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14 min的COCl2浓度变化未标出):
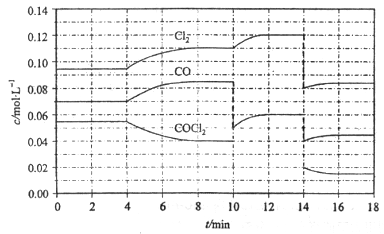
下列说法正确的是
A.COCl2在5~6 min和15~16 min时平均反应速率:v(5~6)< v(15~16)
B.第10 min时,改变反应条件,反应重新达到平衡前:v(正)>v(逆)
C.第12 min时,反应重新达到平衡,c(COCl2)≈ 0.03 mol·L-1
D.第14 min时,改变的条件是减小压强,随着平衡的移动,COCl2的转化率减小
5、选择题 对于可逆反应:C(s)+CO2(g) 2CO(g),在一定温度下其平衡常数为K。下列条件的变化中,能使K值发生变化的是(? )
2CO(g),在一定温度下其平衡常数为K。下列条件的变化中,能使K值发生变化的是(? )
A.将C(s)的表面积增大
B.增大体系的压强
C.升高体系的温度
D.使用合适的催化剂