1、选择题 对于C(s)+H2O(g)?CO(g)+H2(g),的描述正确的是( )
A.达平衡时,各反应物和生成物浓度相等
B.增大压强,对此反应平衡状态无影响
C.达平衡时,C(H2O):C(CO)=1:1
D.达平衡时,H2O转化为CO的速率等于CO转化为H2O的v
参考答案:A、达到平衡状态,各组分的浓度不变,但是不一定各反应物和生成物浓度相等,故A错误;
B、该反应是体积增大的反应,增大压强,平衡向着逆向移动,故B错误;
C、达到平衡状态,各组分的浓度不再变化,不一定满足c(H2O):c(CO)=1:1,故C错误;
D、达到化学平衡状态,正逆反应速率相等,所以H2O转化为CO的速率等于CO转化为H2O的速率,故D正确;
故选D.
本题解析:
本题难度:简单
2、简答题 (16分)甲醇合成反应为:CO(g)+2H2(g)  CH3OH(g)。工业上用天然气为原料,分为两阶段:
CH3OH(g)。工业上用天然气为原料,分为两阶段:
Ⅰ、制备合成气:
用天然气和水制取原料气的方程式为: 。
原料气中常添加CO2以解决合成气中H2过量CO不足问题,请用方程式解释原因 。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________。
Ⅱ、合成甲醇:
(1)反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式____。

实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
| 10min
| 20min
| 30min
| 40min
| 50min
| 60min
|
3000C
| 0.40
| 0.60
| 0.75
| 0.84
| 0.90
| 0.90
|
5000C
| 0.60
| 0.75
| 0.78
| 0.80
| 0.80
| 0.80
|
(2)在3000C反应开始10分钟内,H2的平均反应速率_____________。
(3)5000C平衡常数K=___________。
(4)在另一体积不变的容器中,充入1.2molCO和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率为 。
参考答案:Ⅰ、CH4+H2O(g)  CO+3H2,(2分) CO2+H2
CO+3H2,(2分) CO2+H2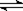 CO+H2O。(2分) 3:1 (2分)
CO+H2O。(2分) 3:1 (2分)
Ⅱ.(1)CO(g)+2H2(g) 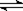 CH3OH(g) ΔH="(a-b)kJ/mol" [ΔH=-(b-a)kJ/mol (3分)
CH3OH(g) ΔH="(a-b)kJ/mol" [ΔH=-(b-a)kJ/mol (3分)
(2) 0.080mol/(L·min) (2分) (3) 25 (2分) (4) 80% (3分)
本题解析:Ⅰ、制备合成气:
天然气的主要成分是甲烷,则用天然气和水制取原料气的方程式为CH4+H2O(g)  CO+3H2。由于在一定条件下CO2能与氢气反应生成CO和水,即CO2+H2
CO+3H2。由于在一定条件下CO2能与氢气反应生成CO和水,即CO2+H2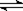 CO+H2O,所以原料气中常添加CO2以解决合成气中H2过量CO不足问题。CO和氢气按照1:2混合时恰好反应生成甲醇,为了使合成气配比最佳,可设甲烷的物质的量是x,CO2是y。甲烷产生的CO和氢气分别是x和3x,CO2消耗的氢气和产生的CO均是y,则有
CO+H2O,所以原料气中常添加CO2以解决合成气中H2过量CO不足问题。CO和氢气按照1:2混合时恰好反应生成甲醇,为了使合成气配比最佳,可设甲烷的物质的量是x,CO2是y。甲烷产生的CO和氢气分别是x和3x,CO2消耗的氢气和产生的CO均是y,则有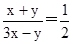 ,解得x:y=3:1。
,解得x:y=3:1。
Ⅱ、合成甲醇:
(1)反应过程中物质能量变化如图所示,根据图像可知反应放出的能量是bkJ—akJ,则合成甲醇的热化学方程式为CO(g)+2H2(g) 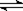 CH3OH(g) ΔH=—(b-a)kJ/mol。
CH3OH(g) ΔH=—(b-a)kJ/mol。
(2)在3000C反应开始10分钟内生成甲醇的物质的量浓度是0.4mol/L,则根据方程式CO(g)+2H2(g)  CH3OH(g)可知消耗氢气的浓度是0.8mol/L,所以H2的平均反应速率=0.8mol/L÷10min=0.080mol/(L·min)。
CH3OH(g)可知消耗氢气的浓度是0.8mol/L,所以H2的平均反应速率=0.8mol/L÷10min=0.080mol/(L·min)。
(3)5000C时反应进行到40min时达到平衡状态,产生甲醇是0.8mol/L,则消耗CO和氢气的浓度分别是0.8mol/L和1.6mo/L,则平衡时CO和氢气的浓度分别是0.2mol/L和0.4mol/L。根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知500℃时平衡常数K=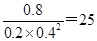 。
。
(4) CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
起始量(mol) 1.2 2 0
转化量(mol) x 2x x
平衡量(mol)1.2-x 2—2x x
所以根据平衡时容器内压强为起始的一半可知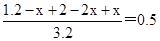
解得x=0.8mol
因此氢气的转化率是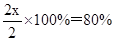
考点:考查可逆反应平衡状态的有关计算
本题难度:困难
3、填空题 已知化学反应①Fe(s)+CO2(g)? FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)? FeO(s)+H2(g),其平衡常数为K2。在温度973?K?和1173?K?情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2。在温度973?K?和1173?K?情况下,K1、K2的值分别如下:

(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)? ?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。
?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。
(3)能判断反应③已达平衡状态的是________。
A.容器中压强不变?B.混合气体中c(CO)不变?C.v正(H2)=v逆(H2O)? D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式__________________。据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是________(填写序号)。
A.缩小反应容器容积? B.扩大反应容器容积?C.降低温度? D.升高温度?E.使用合适的催化剂? F.设法减少CO的量
参考答案:(1)吸热 ?
(2)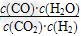 ?
?
(3)BC ?
(4)K3=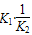 ?;?吸热?;?DF
?;?吸热?;?DF
本题解析:
本题难度:一般
4、选择题 已知:C(s)+CO2(g)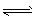 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
[? ]
A.升高温度和减小压强
B.降低温度和减小压强
C.降低温度和增大压强
D.升高温度和增大压强
参考答案:A
本题解析:
本题难度:一般
5、选择题 一定温度下,2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol,将3molSO2和1molO2充入一定容密闭容器中,在催化剂存在下进行下列反应,当达到平衡状态时,下列说法中正确的是( )
A.生成SO3为2mol
B.SO3和SO2物质的量之和一定为3mol
C.放出197kJ的热量
D.SO2的物质的量和SO3物质的量一定相等
参考答案:A、该反应为可逆反应,1mol氧气完全反应才能生成2mol二氧化硫,由于可逆反应不可能完全转化成生成物,所以生成的三氧化硫的物质的量小于2mol,故A错误;
B、根据质量守恒,含有硫原子的物质只有二氧化硫和三氧化硫,反应前有3mol二氧化硫,所以SO3和SO2 物质的量之和一定为3mol,故B正确;
C、热化学方程式中:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol,反应消耗1mol氧气能够放出197kJ热量,由于可能反应中反应物转化率不可能是100%,所以反应中放出的热量小于197kJ,故C错误;
D、达到平衡状态,满足正逆反应速率相等,各组分的浓度不变,而SO2的物质的量和SO3物质的量不一定相等,故D错误;
故选B.
本题解析:
本题难度:一般