1、选择题 等体积的下列溶液,阴离子的总浓度最大的是
A.0.2?mol?L-1K2S
B.0.1?mol?L-1Ba(OH)2
C.0.2?mol?L-1NaCl
D.0.2?mol?L-1(NH4)2SO4
参考答案:A
本题解析:分析:溶液中阴离子的物质的量浓度=盐的浓度×化学式中阴离子个数,以及阴离子是否发生水解据此分析解答.
解答:0.2?mol?L-1K2S、0.1?mol?L-1Ba(OH)2、0.2?mol?L-1NaCl、0.2?mol?L-1(NH4)2SO4中阴离子的浓度都为0.2?mol?L-1,但K2S因水解,使阴离子浓度稍增大:S2-+H2O?HS-+OH-,故选:A.
点评:本题考查了溶液中阴离子物质的量浓度的计算,难度不大,需要注意的是能够水解的离子.
本题难度:困难
2、选择题 同温同压下,等质量的下列气体所占有的体积最大的是
A.O3
B.NH3
C.CO2
D.NO2
参考答案:B
本题解析:分析:根据n=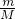 =
=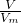 进行计算,注意同温同压下,Vm相等则等质量的气体的体积与摩尔质量成反比,及摩尔质量越大,体积越小,根据摩尔质量大小进行判断.
进行计算,注意同温同压下,Vm相等则等质量的气体的体积与摩尔质量成反比,及摩尔质量越大,体积越小,根据摩尔质量大小进行判断.
解答:A.O3的摩尔质量为48g/mol;
B.NH3的摩尔质量为17g/mol;
C.CO2的摩尔质量为44g/mol;
D.NO2的摩尔质量为26g/mol,
由n=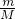 =
=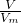 可知,V=
可知,V=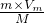 ,同温同压下,Vm相等,则等质量的气体的体积与摩尔质量成反比,及摩尔质量越大,体积越小,摩尔质量最小的为NH3,则NH3的体积最大,
,同温同压下,Vm相等,则等质量的气体的体积与摩尔质量成反比,及摩尔质量越大,体积越小,摩尔质量最小的为NH3,则NH3的体积最大,
故选B.
点评:本题考查阿伏加德罗定律及其推论,题目难度中等,注意根据n=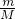 =
=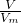 进行计算,注意同温同压下,Vm相等.
进行计算,注意同温同压下,Vm相等.
本题难度:困难
3、选择题 已知甲和乙的某些性质如下表所示:
A.蒸发
B.蒸馏
C.过滤
D.萃取
参考答案:B
本题解析:分析:分离两种互溶的液体采用蒸馏法来实现.
解答:根据题中信息可以看出,甲和乙两物质的熔点相差不大,均易溶于水,互溶,但是沸点相差较大,可以采用蒸馏的方法通过控制沸点的不同来实现二者的分离.
故选B.
点评:本题考查物质的分离、提纯的基本方法选择与应用,难度不大,熟记常见物质的分离方法和原理是解题的关键所在.
本题难度:困难
4、选择题 在硫酸铝、硫酸钾和明矾[KAl(SO4)2?12H2O]的混合溶液中,SO42-的浓度为0.4mol/L,当加入等体积0.4mol/L?KOH溶液时,生成的沉淀恰好完全溶解.则原溶液中K+的浓度约为
A.0.225mol/L
B.0.25mol/L
C.0.45mol/L
D.0.5mol/L
参考答案:D
本题解析:分析:根据当加入等体积0.4mol/L?KOH溶液时,生成的沉淀恰好完全溶解,发生反应Al3++4OH-=AlO2-+2H2O,设体积均为1L,求出原溶液中铝离子、硫酸根的物质的量,根据电荷守恒计算原溶液中钾离子的物质的量,再根据c= 计算.
计算.
解答:设体积均为1L,由于生成沉淀完全溶解,所以反应为
Al3++4OH-=AlO2-+2H2O
?1?4
?X?0.4mol
得x=0.1mol,即含有0.1molAl3+,
原溶液中只含有K+,Al3+和SO42-,根据电荷守恒,则
n(K+)+3n(Al3+)=2n(SO42-),而n(Al3+)=0.1mol,n(SO42-)=0.4mol,
所以n(K+)+3×0.1mol=2×0.4mol,得n(K+)=0.5mol,
故c(K+)=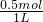 =0.5mol/L,
=0.5mol/L,
故选D.
点评:本题考查有关混合物的计算,题目浓度不大,注意根据质量守恒和电荷守恒的角度解答.
本题难度:一般
5、选择题 通常状况下能共存,且能用浓硫酸干燥的一组气体是
A.H2、O2、N2
B.O2、NO、NO2
C.H2、N2、NH3
D.NH3、HCl、NO2
参考答案:A
本题解析:分析:气体之间不发生化学反应就能共存;浓硫酸是酸能和碱性气体发生反应,所以浓硫酸能干燥酸性气体或中性气体.
解答:A、H2、O2、N2三种气体之间不发生反应,且这三种气体是中性气体,和浓硫酸不反应,所以能共存且能用浓硫酸干燥,故A正确;
B、O2和NO能发生化学反应,所以氧气和一氧化氮不能共存,故B错误;
C、H2、N2、NH3三种气体之间不发生反应,但氨气是碱性气体,能和浓硫酸反应,所以氨气不能用浓硫酸干燥,故C错误;
D、NH3和HCl能发生反应生成氯化铵,所以NH3和HCl不能共存,氨气是碱性气体,能和浓硫酸反应,所以氨气不能用浓硫酸干燥,故D错误.
故选A.
点评:本题考查了气体的共存与干燥,难度不大,注意浓硫酸不能干燥碱性气体,碱石灰不能干燥酸性气体.
本题难度:简单